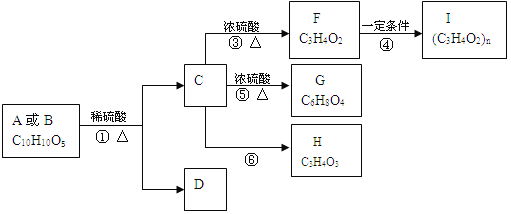
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠、碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:____。
(2)在钠、碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_____。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 1∶91 |
pH | 8.2 | 7.2 | 6.2 |
上表判断NaHSO3溶液显___性,用化学平衡原理解释:___。
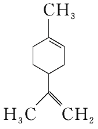
【题目】实验室制备硝基苯的反应原理和实验装置如下:
![]() +HO—NO2
+HO—NO2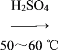
![]() +H2O ΔH<0
+H2O ΔH<0
存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯,有关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
实验步骤如下:
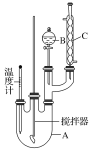
取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混,边滴边搅拌,混合均匀,在50~60 ℃下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝基苯18g。回答下列问题:
(1)装置A的名称是______,装置C的作用是____________。
(2)配制混合液时,_____(填“能”或“不能”)将浓硝酸加入到浓硫酸中,说明理由:________________。
(3)为了使反应在50~60℃下进行,常用的方法是_______。
(4)在洗涤操作中,第二次水洗的作用是________________。
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用直形冷凝管的原因是__________。
(6)本实验所得到的硝基苯产率是_____(结果保留2位有效数字,已知硝酸过量)。
【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
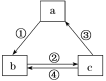
选项 | a | b | c | 箭头上所标数字的反应条件 |
A | AlCl3 | NaAlO2 | Al(OH)3 | ①加入过量的NaOH |
B | Si | SiO2 | H2SiO3 | ②常温加水 |
C | NaOH | NaHCO3 | Na2CO3 | ③加澄清石灰水 |
D | Fe | FeCl3 | FeCl2 | ④加入氯气 |
A.AB.BC.CD.D