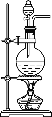
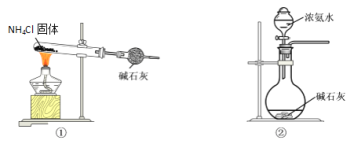
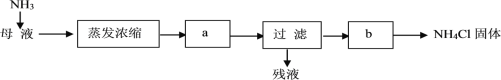
【题目】氮族元素单质及其化合物有着广泛应用。
![]() 在
在![]() 密闭容器中放入
密闭容器中放入![]()
![]() ,一定温度进行如下反应
,一定温度进行如下反应![]()
反应时间![]() 与容器内气体总压强
与容器内气体总压强![]() 的数据见下表:
的数据见下表:
时间 温度 | 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| -- | -- | -- |
|
|
回答下列问题:
![]() 的电子式为______。
的电子式为______。
![]() 温度下,反应平衡常数
温度下,反应平衡常数![]() ______。
______。
![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() ,
,![]() 的平衡转化率
的平衡转化率![]() ______
______![]() 。
。
![]() 在一定条件下发生如下分解:
在一定条件下发生如下分解:![]() 在温度和容积不变的条件下,能说明该反应已达到平衡状态的是______
在温度和容积不变的条件下,能说明该反应已达到平衡状态的是______![]() 填字母序号
填字母序号。
a.n(N2O)=n(NO2) b.容器内压强保持不变 c.υ正(N2O)=υ正(NO2) d.气体颜色保持不变
【题目】钴酸锂废极片中钴回收的某种工艺流程如下图所示,其中废极片的主要成分为钴酸锂(LiCoO2)和金属铝,最终可得到Co2O3及锂盐。
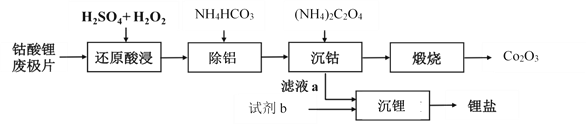
(1) “还原酸浸”过程中,大部分LiCoO2可转化为CoSO4,请将该反应的化学方程式补充完整:2LiCoO2+3H2SO4+□ ![]() □CoSO4+□ +□ + □ 。__________
□CoSO4+□ +□ + □ 。__________
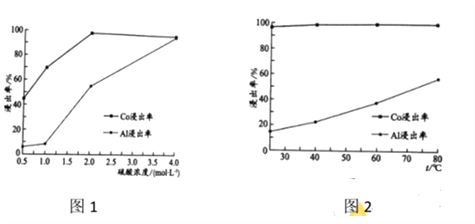
(2) “还原酸浸”过程中,Co、Al浸出率(进入溶液中的某元素质量占固体中该元素总质量的百分数)受硫酸浓度及温度(t)的影响分别如图1和图2所示。工艺流程中所选择的硫酸浓度为2 mol.L-1,温度为80 oC,推测其原因是________。
A. Co的浸出率较高 B. Co和Al浸出的速率较快
C. Al的浸出率较高 D. 双氧水较易分解
(3)加入(NH4)2C2O4后得CoC2O4沉淀。写出CoC2O4沉淀在空气中高温煅烧得到Co2O3的反应的化学方程式:________。
(4)若初始投入钴酸锂废极片的质量为1 kg,煅烧后获得Co2O3的质量为83 g,已知Co的浸出率为90%,则钴酸锂废极片中钴元素的质量分数约为________(小数点后保留两位)。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1 mol·L-1,部分锂盐的溶解度数据如下表所示。
温度 | Li2SO4 | Li2CO3 |
0 oC | 36.1 g | 1.33 g |
100 oC | 24.0 g | 0.72 g |
结合数据分析,沉锂过程所用的试剂b是________(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,________,洗涤干燥。
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应![]() 正反应放热
正反应放热![]() ,测得反应的相关数据如下:
,测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度 | 700 | 700 | 800 |
反应物投入量 |
|
|
|
平衡 |
|
|
|
平衡 |
|
|
|
平衡体系总压强 |
|
|
|
物质的平衡转化率α |
|
|
|
平衡常数K |
|
|
|
下列说法正确的是![]()
![]()
A. ![]() ,
,![]() B.
B. ![]() ,
,![]()
C. ![]() ,
,![]() D.
D. ![]() ,
,![]()
【题目】某研究性学习小组欲开展一次以化学为主题的活动,确定的课题是“研究浓硫酸与木炭粉在加热条件下反应的产物”。根据小组成员的推测,浓硫酸与木炭粉在加热条件下反应的产物可能有CO2、SO2,为了验证推测,小组讨论用以下装置进行实验:
编号 | a | b | c |
装置 |
品红 酸性KMnO4 品红 溶液 溶液 溶液 A B C |
|
|
请回答:
⑴ 实验时可观察装置a中A瓶溶液褪色,C瓶溶液不褪色。则A瓶溶液的作用___,C瓶溶液的作用_____;
⑵ 装置b中所加的液体是________,装置b可验证的产物是________;
⑶ 甲、乙两位同学分别设计了两套不同装置。甲的装置顺序:c→b→a,乙的装置顺序:c→a→b。你认为合理的是(填“甲”或“乙”)__;
⑷写出装置c中发生的化学方程式: __________
【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)T1℃时,在2L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为______(保留一位小数);在T1℃下反应2SO2(g)+O2(g) ![]() 2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
②下表为不同温度(T)下反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0的化学平衡常数(K):
2SO3(g) △H<0的化学平衡常数(K):
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,其他条件相同,在T1、T2、T3三种不同温度下,反应从开始至达到平衡时所需要的时间最长的是 _____________。(填“T1”、“T2”或“T3”)
(2)在体系恒压的条件下进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。