【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:
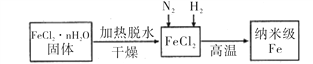
(1)纳米级Fe和稀盐酸反应的离子方程式为_______________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2 _____________________________________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为______________________________________。
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。

(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是 ______________________。
(5)甲装置中仪器a的名称为_______________________。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤 | 实验操作 | 实验现象 |
I | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
II | 向实验I得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字描述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________(结果保留三位有效数字)。
【题目】化学反应伴随能量变化,其中能量的主要形式是热能。
I:如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,往试管中放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
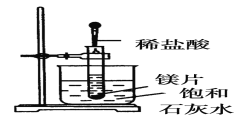
(1)实验中观察到的现象是________________________。
(2)产生上述现象的原因是________________________。
(3)写出有关反应的离子方程式__________________________。
(4)由实验推知,MgCl2和H2的总能量________(填“大于”“小于”或“等于”)镁片和HCl的总能量。
II:从能量变化的角度研究反应:2H2+O2=2H2O。
(1)如图能正确表示该反应中能量变化的是_________。
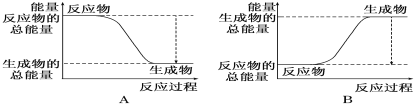
(2)已知断开或形成1 mol化学键吸收或放出的能量,叫做该化学键的键能,单位为kJ·mol-1。一些键能数据如下表:
化学键 | H—H | O=O | H—O |
键能(kJ·mol-1) | 436 | 496 | 463 |
请回答:
断裂反应物2 mol H2和1 mol O2的化学键,需要_______的总能量为______kJ;形成生成物2 mol H2 O的化学键,需要______的总能量为______kJ。所以该反应能量变化值的大小 ____________ kJ(填数值)。
【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高电子层符号为__________,该电子层具有的原子轨道数为______.
②LiBH4由Li+和BH![]() 构成,BH
构成,BH![]() 的立体构型是______,B原子的杂化轨道类型是_______.
的立体构型是______,B原子的杂化轨道类型是_______.
③Li、B元素的电负性由小到大的顺序为_______________________.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+________H-(填“>”“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物. M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1 451 | 7 733 | 10 540 | 13 630 |
M是________族元素.
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488 pm,Na+半径为102 pm,H-的半径为142pm,NaH的理论密度是________g·cm-3.(仅写表达式,不计算)