【题目】某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是__________________________________。
(2)已知:20℃时溶解度/g
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________________。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有_______________________________________。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因________。
(4)步骤Ⅲ中,加入Na2SO3的目的是_______________________。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:______
![]()
②下面检测钝化效果的方法合理的是______。
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
【题目】下表列出前20号元素中的某些元素性质的一些数据:
元素 | A | B | C | D | E | F | G | H | I | J |
原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是____(填编号)。比元素B原子序数大10的元素在元素周期表中的位置:第____周期第____族,其基态原子的核外电子排布式是___________。
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是____(写分子式,写出两种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是_________、___________。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。 其分子中共形成____个σ键,____个π键。
(4)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第_____周期、第____族。
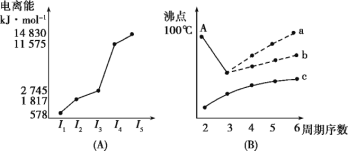
图(B)是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第____族元素氢化物的沸点的变化规律。不同同学对某主族元素的氢化物的沸点变化趋势画出了两条折线——折线a和折线b,你认为正确的是____,理由是_______________。
【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+=Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C | 用惰性电极电解NaCl溶液 2Cl-+2H2O | 用惰性电极电解MgBr2溶液 2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性 H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性 H++OH-=H2O |
A.AB.BC.CD.D