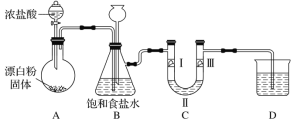
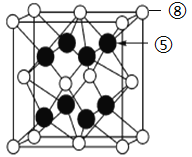
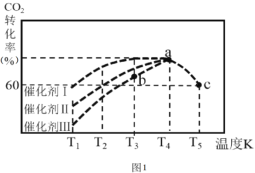
0 196052 196060 196066 196070 196076 196078 196082 196088 196090 196096 196102 196106 196108 196112 196118 196120 196126 196130 196132 196136 196138 196142 196144 196146 196147 196148 196150 196151 196152 196154 196156 196160 196162 196166 196168 196172 196178 196180 196186 196190 196192 196196 196202 196208 196210 196216 196220 196222 196228 196232 196238 196246 203614