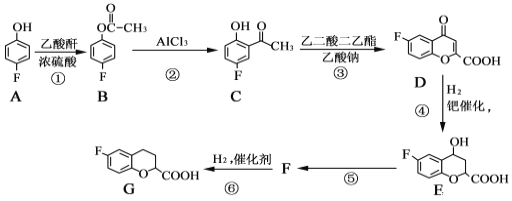
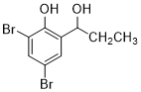
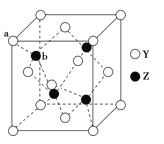
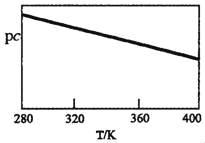
0 195963 195971 195977 195981 195987 195989 195993 195999 196001 196007 196013 196017 196019 196023 196029 196031 196037 196041 196043 196047 196049 196053 196055 196057 196058 196059 196061 196062 196063 196065 196067 196071 196073 196077 196079 196083 196089 196091 196097 196101 196103 196107 196113 196119 196121 196127 196131 196133 196139 196143 196149 196157 203614