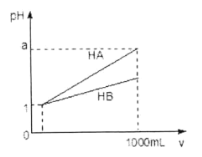
【题目】下列反应既属于离子反应又属于氧化还原反应的是 ( )
A.C+O2 ![]() CO2
CO2
B.2 KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
C.HCl+NaOH = NaCl+H2O
D.Fe+CuSO4=Cu+FeSO4
【题目】硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
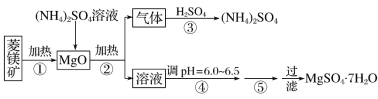
(1)步骤②中发生反应的离子方程式为__________________________________________。
(2)步骤④中调节pH=6.0~6.5的目的是_______________________________________。
(3)步骤⑤的操作为________________________________________________________。
(4)若要除去MgSO4溶液中的FeSO4应先加________,再加入过量__________,过滤即可把杂质除尽;请用离子方程式以及文字说明除杂原理___________________________________
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25 ℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为____________(已知25 ℃时 ,Ksp[Mg(OH)2]=5.6×10-12 )。