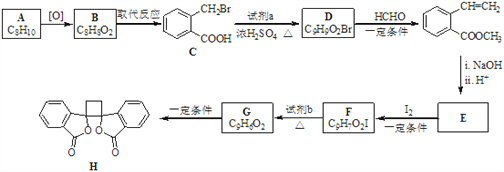
【题目】钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生 6.72 L(标准状况下)氮气,至少需要叠氮化钠_____g。
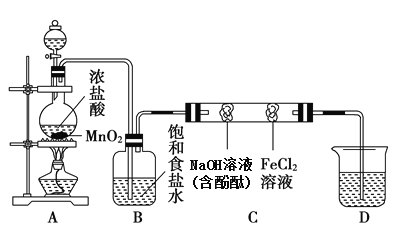
(2)为实现金属钠在隔绝空气条件下与水反应并收集生成的气体,某研究 性学习小组设计了如图发生装置.
①写出 Na 与水反应的离子方程式_____。
②Y 液体可以选用_____
A.煤油 B.酒精 C.四氯化碳
③实验前检验该装置气密性的方法是:关闭止水夹,通过_________(填装置名称)向试管中加水至产生液面差,一段时间后,_____(填现象),则气密性良好。
(3)1mol 过氧化钠与 1.6mol 碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质及对应的物质的量(可不填满)。
物质 | 物质的量/mol |
__________ | __________ |
__________ | __________ |
【题目】某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①配制1.60mol/L稀盐酸和1.60mol/LNaOH溶液;
②向一粒研碎后的药片(1.60g)中加入20.00mL蒸馏水;
③用1.60mol/LNaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL1.60mol/L稀盐酸。
请回答下列问题:
(1)正确的操作顺序是__________________________(填序号)
(2)测定过程中发生反应的离子方程式为___________________________________、___________________________。
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下:
测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
V(NaOH(aq))/mL | 13.00 | 12.90 | 13.10 | 13.00 |
实验室现有50mL、100mL、250mL、500mL4种规格的容量瓶,则配制NaOH溶液应选用的容量瓶的规格为___________。
(4)①配制上述NaOH溶液时需要的主要仪器有托盘天平、烧杯、________________。
②该实验的第一步是计算,称取_____gNaOH固体。
③用烧杯称取NaOH固体时,下列操作步骤的正确顺序是__________________(相同的操作可重复使用)。
a.调整天平零点 b.将砝码放回砝码盒 c.将游码拨回零刻度处
d.称取小烧杯的质量 e.称取小烧杯和NaOH的质量 f.记录称量的数据
④称取NaOH固体时,若将砝码放在天平左盘,将NaOH固体放在右盘,游码在1.4的刻度线处。则实际称得的NaOH固体为____________g。
⑤写出下列操作对所配制的溶液浓度造成的影响(填“偏大”“偏小”或“不变”)。
a.称量时砝码与NaOH固体在托盘中位置颠倒:______________。
b.未洗涤烧杯及玻璃棒:______________。
c.定容摇匀后,发现液面低于刻度线,重新加水至刻度线:______________。
⑥取50mL上述配制准确的NaOH溶液,加水稀释至100mL,所得NaOH溶液的物质的量浓度为________________。