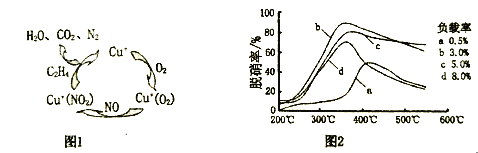
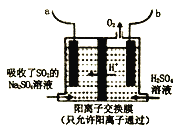
0 195789 195797 195803 195807 195813 195815 195819 195825 195827 195833 195839 195843 195845 195849 195855 195857 195863 195867 195869 195873 195875 195879 195881 195883 195884 195885 195887 195888 195889 195891 195893 195897 195899 195903 195905 195909 195915 195917 195923 195927 195929 195933 195939 195945 195947 195953 195957 195959 195965 195969 195975 195983 203614