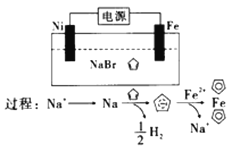
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
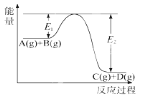
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
【题目】下图是闪锌矿(主要成分是![]() ,含有少量
,含有少量![]() )制备
)制备![]() 的一种工艺流程:
的一种工艺流程:
![]()
资料:相关金属离子浓度为![]() 时形成氢氧化物沉淀的
时形成氢氧化物沉淀的![]() 范围如下:
范围如下:
金属离子 |
|
|
|
开始沉淀的 | 1.5 | 6.3 | 6.2 |
沉淀完全的 | 2.8 | 8.3 | 8.2 |
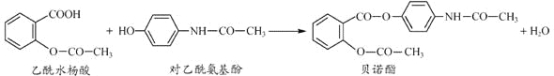
(1)闪锌矿在溶浸之前会将其粉碎,目的是______________。
(2)溶浸过程使用过量的![]() 溶液和
溶液和![]() 浸取矿粉,发生的主要反应是:
浸取矿粉,发生的主要反应是:
![]() 。下列判断正确的是____________(填字母序号)。
。下列判断正确的是____________(填字母序号)。
a.浸出液中含有![]() 等阳离子
等阳离子
b.加入硫酸,可以抑制![]() 水解
水解
c.若改用![]() 溶液进行浸取,将发生反应:
溶液进行浸取,将发生反应:![]()
(3)工业除铁过程需要控制沉淀速率,因此分为还原和氧化两步先后进行,如下图。还原过程将部分![]() 转化为
转化为![]() ,得到
,得到![]() 小于1.5的溶液。氧化过程向溶液中先加入氧化物a,再通入
小于1.5的溶液。氧化过程向溶液中先加入氧化物a,再通入![]() 。
。
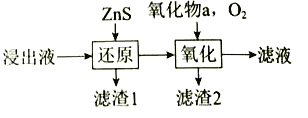
①a可以是______________,加入a的作用是_______________。
②除铁过程中可以控制溶液中![]() 的操作是_______________。
的操作是_______________。
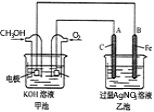
【题目】某小组研究了铜片与![]() 反应的速率,实现现象记录如下表。
反应的速率,实现现象记录如下表。
实验 | 时间段 | 现象 |
|
| 铜片表面出现极少气泡 |
| 铜片表面产生较多气泡,溶液呈很浅的蓝色 | |
| 铜片表面均匀冒出大量气泡 | |
| 铜片表面产生较少气泡,溶液蓝色明显变深,液面上方呈浅棕色 |
为探究影响该反应速率的主要因素,小组进行如下实验。
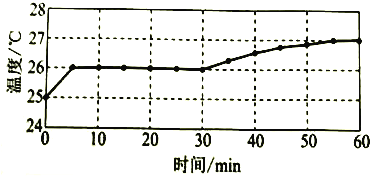
实验I:监测上述反应过程中溶液温度的变化,所得曲线如下图。
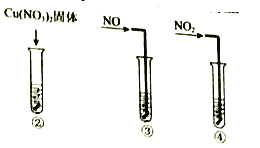
实验II:②-④试管中加入大小、形状相同的铜片和相同体积、 ![]() 。结果显示:
。结果显示:![]() 对
对![]() 和
和![]() 反应速率的影响均不明显,
反应速率的影响均不明显,![]() 能明显加快该反应的速率。
能明显加快该反应的速率。
实验III:在试管中加入铜片和![]() ,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有
,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有![]() 。
。
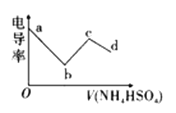
(1)根据表格中的现象,描述该反应的速率随时间的变化情况:____________。
(2)实验![]() 的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
(3)实验II的目的是:__________
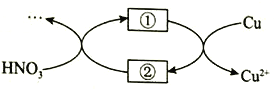
(4)小组同学查阅资料后推测:该反应由于生成某中间产物而加快了反应速率。请结合实验II、III,在下图方框内填入相应的微粒符号①____②_____,以补全催化机理。
(5)为验证(4)中猜想,还需补充一个实验:__________(请写出操作和现象)。