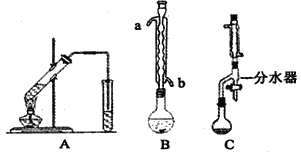
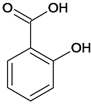
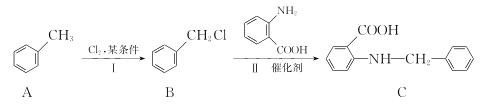
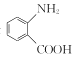
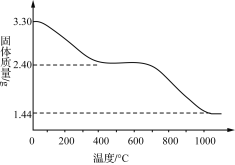
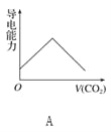
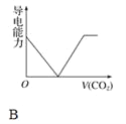
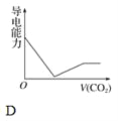
0 195669 195677 195683 195687 195693 195695 195699 195705 195707 195713 195719 195723 195725 195729 195735 195737 195743 195747 195749 195753 195755 195759 195761 195763 195764 195765 195767 195768 195769 195771 195773 195777 195779 195783 195785 195789 195795 195797 195803 195807 195809 195813 195819 195825 195827 195833 195837 195839 195845 195849 195855 195863 203614