【题目】目前汽车尾气中的NO处理有以下几种方法:
(1)在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H 。
N2(g)+2CO2(g) △H 。
①已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1,C(s)+O2(g)=CO2(g) △H2=-393.5 kJ·mol-1,2C(s)+O2(g)=2CO(g)△H3=-221kJ·mol-1,则△H=______。
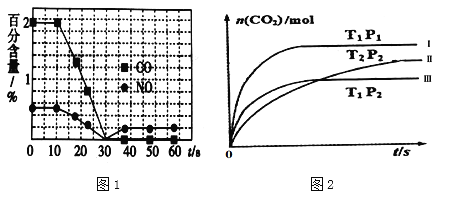
②一个兴趣小组对某汽车冷启动时的尾气催化处理过程中CO、NO百分含量随时间变化如图1所示,前0﹣10s 阶段,CO、NO百分含量没明显变化的原因是_____________________。同时该小组在固定容积为2L的密闭容器中通入NO和CO各2mol进行反应,n(CO2)随温度(T)、压强(P)和时间(t)的变化曲线如图2所示,图中的曲线Ⅰ、Ⅱ、Ⅲ对应反应从开始到平衡时用CO2表示的平均反应速率分别为v(Ⅰ)、v(Ⅱ)、v(Ⅲ),则三者大小关系为______________。
(2)活性炭也可用于处理汽车尾气中的NO。在1L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成CO2、N2两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如下表:
活性炭/mol | NO/mol | CO2/mol | N2/mol | P/MPa | |
200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
X | 2.005 | 0.0500 | 0.0250 | 0.0250 | 4.56 |
容器中发生反应的化学方程式为C(s) +2NO(g) CO2(g) +N2(g);根据上表数据,并判断X_____200℃(用“>”、“<“或“=”填空),计算反应体系在200℃时的平衡常数Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
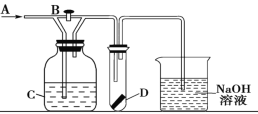
(3)用间接电化学法除去NO的过程,如图所示。已知电解池的阴极室中溶液的pH在4~7之间,B极为_________(填“阳极”或“阴极”);写出A极的电极反应式:____________。

【题目】处理、回收CO是环境科学家研究的热点课题。
(1)CO用于处理犬气污染物N2O所发生的反应为:N2O(g)+CO(g)![]() CO2(g)+N2(g) ΔH,几种物质的相对能量如下:
CO2(g)+N2(g) ΔH,几种物质的相对能量如下:
物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
相对能量kJ·mol-1 | 475.5 | 283 | 0 | 393.5 |
①ΔH=______kJ·mol-1;改变下列“量”,一定会引起ΔH发生变化的是____填代号)
A.反应物浓度 B.催化剂 C.化学计量数
②有人提出上述反应可以用Fe作催化剂。其总反应分两步进行:第一步:Fe+N2O=FeO+N2,第二步:______(写化学方程式)。第二步反应不影响总反应达到平衡所用时间,由此推知,第二步反应活化能____第一步反应活化能(填“大于”、“小于”或等于”)。
(2)在实验室,釆用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5(g)+5CO(g)![]() 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。

①相对曲线a,曲线b仅改变一个条件,改变的条件可能是______。
②在此温度下,该可逆反应的平衡常数K=_____(用含x的代数式表示)。
(3)工业上,用CO和H2合成CH3OH。在1L恒容密闭容器中充入1molCO(g)和nmolH2,在250℃发生反应:CO(g)+2H2(g)![]() CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___。
CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___。

(4)CO-空气碱性燃料电池(用KOH作电解质),当恰好完全生成KHCO3时停止放电。写出此时负极的电极反应式:______。