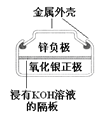
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
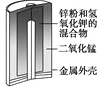
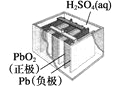
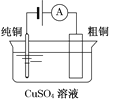
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
【题目】下列实验不能达到预期实验目的是()
序号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一会过滤 | 除去MgCl2中少量FeCl3 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
【题目】二甲醚CH3OCH3又称甲醚,熔点-141.5℃,沸点-24.9℃。由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g) ![]() CH3OH(g) △H1 =-90.0 kJ·mol-1
CH3OH(g) △H1 =-90.0 kJ·mol-1
②2CH3OH(g) ![]() CH3OCH3(g)+ H2O(g) △H2 = -20.0 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H2 = -20.0 kJ·mol-1
回答下列问题:
(1)反应①在_____________(填“低温”或“高温”)下易自发进行。
(2)写出由合成气(CO、H2)直接制备CH3OCH3的热化学方程式:______________。
(3)温度为500K时,在2L的密闭容器中充入2mol CO和6molH2发生反应①、②,5min时达到平衡,平衡时CO的转化率为60%,c(CH3OCH3) = 0.2 mol·L-1,用H2表示反应①的速率是________,反应②的平衡常数K =____________。
(4)研究发现,在体积相同的容器中加入物质的量相同的CO和H2发生反应①、②,在不同温度和有无催化剂组合下经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO转化(%) | CH3OCH3选择性(%) |
473 | 无 | 10 | 36 |
500 | 无 | 12 | 39 |
500 | Cu/ZnO | 20 | 81 |
(备注)二甲醚选择性:转化的CO中生成CH3OCH3百分比
①相同温度下,选用Cu/ZnO作催化剂,该催化剂能_______ (填标号)。
A.促进平衡正向移动 B.提高反应速率 C.降低反应的活化能
D.改变反应的焓变 E.提高CO的平衡转化率
②表中实验数据表明,在500K时,催化剂Cu/ZnO对CO转化成CH3OCH3的选择性有显著的影响,其原因是__________________________。