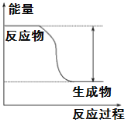
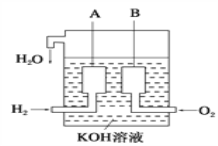
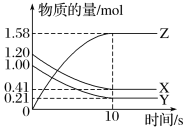
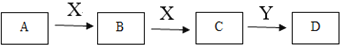【题目】现有下列表格中的几种离子
阳离子 | Na+、Mg2+、A13+、Ba2+、NH4+ |
阴离子 | OH-、C1-、NO3-、SO42-、HSO4- |
A、B、C、D、E是由它们组成的五种可溶于水的固体(每种离子只能用-次),分别取它们进行实验,结果如下:
①将D与E的溶液混合加热,产生刺激性气味的气体;
②将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解;
③向-定量的E溶液中逐滴加入C溶液,先无明显现象,后来产生白色沉淀,且该沉淀可溶于A溶液;
④D固体在-定温度下可以分解为水和另外两种均为空气主要成分的气体单质。
根据上述信息回答下列问题:
(1)根据以上条件推断并写出下列物质的化学式:B________;C_______;
(2)写出A溶液与E溶液恰好完全反应至溶液呈中性的离子方程式:_________________________________________________________。
(3)写出D固体分解的化学方程式__________________________________。
(4)在含2 mol C溶质的溶液中加入含3.5mol E溶质的溶液,发生反应的离子方程式__________________________
【题目】回收的废旧锌锰干电池经过处理后可得到锰粉(含MnO2、Mn(OH)2、Fe和炭粉等),由锰粉为主要原料制备高性能磁性材料碳酸锰(MnCO3)的工艺流程如下:
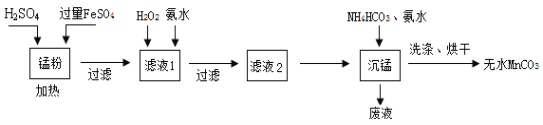
已知:①2H2SO4 + MnO2 + 2FeSO4 = MnSO4 + Fe2(SO4)3 + 2H2O
②部分氢氧化物的Ksp(近似值)如下表(25 ℃)
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp | 10-13 | 10-17 | 10-38 |
根据上图流程及有关数据回答下列问题。
(1)锰粉酸溶时,过量FeSO4所起的作用为______________________。
(2)往滤液1中先加入H2O2的目的是氧化Fe2+,该反应的离子方程式为________________,后加入氨水的目的是调节pH除去杂质离子,使滤液中的杂质离子沉淀完全(残留在溶液中的离子浓度≤ l0-5 mol·L-1),常温下测得溶液中c(Mn2+)=0.1 mol·L-1,则需调节溶液的pH范围为_______________。
(3)沉锰工序中,加入氨水的目的是(从化学平衡移动的角度解释)___________,沉锰工序中判断沉淀已经洗涤干净的实验操作是________________________________。
(4)沉锰后废液中的主要成份为_____________________________。