【题目】丙烯是一种重要的化工原料,可通过丁烯催化裂解或丁烯与甲醇耦合制备。
Ⅰ.丁烯催化裂解生产丙烯的反应方程式是2C4H8(g)![]() 2C3H6(g)+ C2H4(g)。
2C3H6(g)+ C2H4(g)。
(1)已知C4H8、C3H6、C2H4的燃烧热分别为2710.0 kJ![]() mol-1、2050.0 kJ
mol-1、2050.0 kJ![]() mol-1、1410.0 kJ
mol-1、1410.0 kJ![]() mol-1,则该反应的ΔH=_______ kJ
mol-1,则该反应的ΔH=_______ kJ![]() mol-1。下列操作既能提高C4H8的平衡转化率,又能加快反应速率的是_________。
mol-1。下列操作既能提高C4H8的平衡转化率,又能加快反应速率的是_________。
A.升高温度 B.增大压强
C.增大C4H8的浓度 D.使用更高效的催化剂
(2)某温度下,在体积为2 L的刚性密闭容器中充入2.00 mol C4H8进行上述反应,容器内的总压强p随时间t的变化如下表所示:
反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
总压强p/kPa | 4.00 | 4.51 | 4.80 | 4.91 | 4.96 | 5.00 | 5.00 |
则0~10 min内υ(C4H8)=_______ mol![]() L-1
L-1![]() min-1,该温度下的平衡常数K=_______kPa(用气体的分压表示)。
min-1,该温度下的平衡常数K=_______kPa(用气体的分压表示)。
Ⅱ.将甲醇转化耦合到丁烯裂解过程中生产丙烯,主要涉及下列反应:
① 2C4H8(g)![]() 2C3H6(g)+ 2H4(g) ΔH>0
2C3H6(g)+ 2H4(g) ΔH>0
② 2CH3OH(g)![]() C2H4(g) + 2H2O(g) ΔH<0
C2H4(g) + 2H2O(g) ΔH<0
③ C2H4(g)+ C4H8(g)![]() 2C3H6(g) ΔH<0
2C3H6(g) ΔH<0
已知:甲醇吸附在催化剂上,可以活化催化剂;甲醇浓度过大也会抑制丁烯在催化剂上的转化。
(3)图1是C3H6及某些副产物的产率与n(CH3OH)/n(C4H8)的关系曲线。最佳的n(CH3OH)/n(C4H8)约为_________。

(4)图2是某压强下,将CH3OH和C4H8按一定的物质的量之比投料,反应达到平衡时C3H6的体积分数随温度的变化曲线。由图可知平衡时C3H6的体积分数随温度的升高呈现先升高后降低,其原因可能是__________________________________________________。

(5)下列有关将甲醇转化耦合到丁烯裂解过程中生产丙烯的说法正确的是________。
A.增大甲醇的通入量一定可以促进丁烯裂解
B.甲醇转化生成的水可以减少催化剂上的积碳,延长催化剂的寿命
C.提高甲醇与丁烯的物质的量的比值不能提高丙烯的平衡组成
D.将甲醇转化引入丁烯的裂解中,可以实现反应热效应平衡,降低能耗
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +3、+5、 |
|
下列叙述正确的是
A.X、Y的单质与稀盐酸反应速率X<Y
B.一定条件下,W单质可以将Z从其氢化物中置换出来
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.常温下,Z单质与W的常见单质直接生成ZW2
【题目】由甲醇![]() 、氧气和
、氧气和![]() 溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
(1)写出该电池负极电极反应式______
(2)若以该电池为电源,用石墨作电极电解含有如下离子的溶液。
离子 |
|
|
|
|
|
|
|
|
|
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上发生的电极反应为______;阴极收集到的气体体积为(标准状况)______。
(3)若用该电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移![]() 时,实际上消耗的甲醇的质量比理论上大,可能原因是______。
时,实际上消耗的甲醇的质量比理论上大,可能原因是______。
【题目】电子工业上使用![]() 溶液蚀刻铜箔制造印刷电路板。在该制备工艺中,为了实现资源再生,减少污染,某兴趣小组提出废液处理和资源回收的过程如下:
溶液蚀刻铜箔制造印刷电路板。在该制备工艺中,为了实现资源再生,减少污染,某兴趣小组提出废液处理和资源回收的过程如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液![]() ,同时鼓入足量的空气。
,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4×10-38,回答下列问题:
(1)![]() 蚀刻铜箔反应的离子方程式为______;过程Ⅰ加入铁屑的主要作用是______
蚀刻铜箔反应的离子方程式为______;过程Ⅰ加入铁屑的主要作用是______
(2)过程Ⅱ中鼓入足量的空气发生反应的化学方程式为______
(3)过程Ⅱ中调节溶液的![]() 为5,金属离子浓度为______。(列式计算)
为5,金属离子浓度为______。(列式计算)
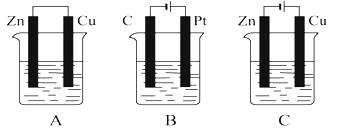
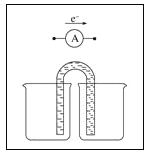
(4)另一兴趣小组将制造印刷电路板![]() 蚀刻铜箔的反应设计成一个原电池。请将方框中实验装置图补充完整,并作相应标注(标出电极材料、电解质溶液)。限选材料:
蚀刻铜箔的反应设计成一个原电池。请将方框中实验装置图补充完整,并作相应标注(标出电极材料、电解质溶液)。限选材料:![]() ,
,![]() ,
,![]() ,
,![]() :铜片,铁片,锌片,石墨和导线。
:铜片,铁片,锌片,石墨和导线。
(5)废旧印刷电路板经粉碎分离能得到非金属粉末和金属粉末,也可回收利用实现资源再生,减少污染。印刷电路板的金属粉末用![]()
![]() 和
和![]()
![]() 的混合溶液处理,溶出印刷电路板金属粉末中的铜。控制其他条件相同时,测得不同温下铜的平均溶解速率(见下表)。
的混合溶液处理,溶出印刷电路板金属粉末中的铜。控制其他条件相同时,测得不同温下铜的平均溶解速率(见下表)。
温度 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 |
|
|
|
|
|
|
|
①当温度高于![]() 时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
②在提纯后的![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和
和![]() 溶液,加热,生成
溶液,加热,生成![]() 沉淀。制备
沉淀。制备![]() 的离子方程式是______。
的离子方程式是______。