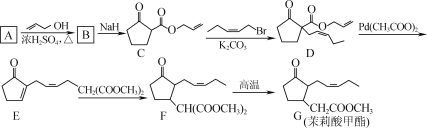
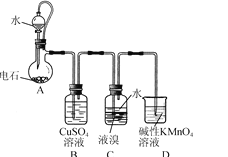
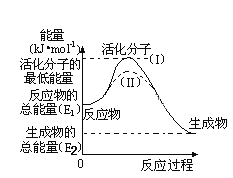
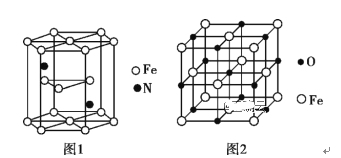
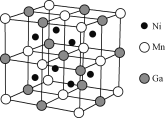
【题目】化学与社会、生活密切相关。对下列现象或事实的解释不正确的是( )
选项 | 现象或事实 | 解释或对应的离子方程式 |
A | 用热的纯碱溶液洗去油污 | CO32-+H2O 溶液呈碱性,温度升高碱性增强 |
B | 酸雨样品在空气中放置pH减小 | SO2+H2O=H2SO3 |
C | 用泡沫灭火器灭火 | Al3+ + 3HCO3-= Al(OH)3↓+3CO2↑ |
D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体可以完全分解成为气体而除去 |
A. A B. B C. C D. D
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。

序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
(1)实验1、2的目的是研究__________因素对H2O2分解速率的影响。
(2)实验1对应的化学方程式为___________________________。
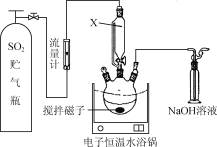
实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图所示的实验。可通过观察_________得出结论。 有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________。
实验三:已知在高锰酸钾(KMnO4)酸性溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快。
(1)写出硫酸酸化的高锰酸钾溶液和草酸溶液反应的化学方程式____________
(2)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是______。
(3)若用实验证明你的猜想/span>,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是__________。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(4)若实验过程中将2.0mL0.10mol/LH2C2O4溶液与4.0mL0.010mol/L酸性KMnO4溶液混合(忽略溶液混合后体积的变化),测得溶液的褪色时间为40s,这段时间内平均反应速率v(KMnO4)=__________mol·L-1·min-1。