【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以饱和食盐水、NH3、CO2为原料先制得NaHCO3,进而生产出纯碱。回答下列问题:
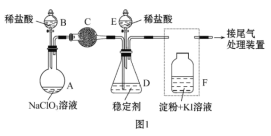
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

(1)乙装置中的试剂是_________________。
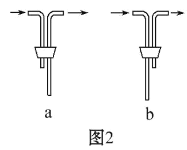
(2)另一位同学用图中戊装置(其他装置未画出)进行实验。实验时,须先从____________管通入________气体。
(3)有同学建议在戊装置的b管下端连接己装置,理由是____________________。
(4)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g 水):
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ | 50 ℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析丙、戊装置中使用冷却水或者冰水的原因:____________。
(5)该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为a g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行下图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是___________(填字母)。
a 在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b 在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c 在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为_______________。
【题目】二氯化二硫(S2Cl2)是一种常用于橡胶硫化、有机物氯化的试剂,甲同学查阅资料:①将干燥的氯气在110~140 ℃ 间与硫反应,即可得S2Cl2粗品;②有关物质的部分性质如表所示:
物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
S | 112.8 | 444.6 | 略 |
S2Cl2 | -77 | 137 | ①一种橙黄色的液体,遇水易水解,有淡黄色固体出现,同时产生能使品红溶液褪色的气体。 ②300 ℃以上完全分解。③S2Cl2+Cl2=2SCl2 |
设计如图所示实验装置在实验室合成S2Cl2:
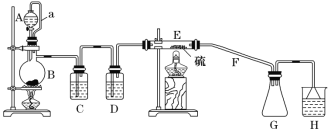
回答以下问题:
(1)仪器A的名称是_______________。
(2)B中所发生反应的离子方程式为___________________________________。
(3)C装置的作用是___________________________________ 。
(4)S2Cl2粗品中可能混有的杂质是_______________ (写其中一种,填化学式)。
(5)乙同学发现,该装置中除了E处的温度不能过高外,还有一处重大缺陷需改进,否则会导致S2Cl2的产率大大降低,原因是______________________________ (用化学方程式表示);请简要提出改进方案:________________________________________________。
(6)H中的溶液可以选择下列试剂中的__________ (填字母)。
A 碳酸钠溶液 B 氯化铁溶液 C 高锰酸钾溶液 D 亚硫酸钠溶液
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 最外层电子数是次外层电子数的2倍 |
X | L层有三个未成对电子 |
Y | L层p电子数比s电子数多两个 |
Z | 元素的最高正价为+7价 |
下列说法正确的是
A. Z离子的结构示意图为:![]()
B. 分子TY2中各原子均满足8电子稳定结构
C. T元素在周期表中的表示为:
D. XZ3含有非极性键