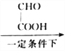【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
【题目】亚硝酰氯是工业上重要的原料,是合成有机物的中间体。
2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0
2ClNO(g) △H<0
(1)在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应达到平衡。测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1 ,则平衡后NO的转化率α1=_____________。其它条件保持不变,反应在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”)。
(2)若使反应2NO(g)+Cl2(g)![]() 2ClNO(g) 的平衡常数增大,可采用的措施是___________。
2ClNO(g) 的平衡常数增大,可采用的措施是___________。
(3)将NO与Cl2按物质的量之比2∶1充入一绝热密闭容器中,发生反应:2NO(g)+Cl2(g)![]() 2ClNO △H<0,实验测得NO的转化率α(NO)随时间的变化经如图所示。NO(g)的转化率α(NO)在t2~t3时间段内降低的原因是______________________________。
2ClNO △H<0,实验测得NO的转化率α(NO)随时间的变化经如图所示。NO(g)的转化率α(NO)在t2~t3时间段内降低的原因是______________________________。

(4)在其他条件相同时,向五个恒温的密闭容器中分别充入1molCl2与2molNO,发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H< 0,部分反应条件及平衡时ClNO的含量如下表所示:
2ClNO(g) △H< 0,部分反应条件及平衡时ClNO的含量如下表所示:
容器编号 | 温度/℃ | 容器体积/L | 平衡时ClNO含量(占比) |
Ⅰ | T1 | 2 | 2/3 |
Ⅱ | T2=T1 | 3 | W2 |
Ⅲ | T3>T1 | V3 | 2/3 |
Ⅳ | T4 | V4 | W4 |
Ⅴ | T5 | V5 | W5 |
①V3________2 (填写“大于”、“小于”或“等于”);
②容器Ⅱ中化学平衡常数K=_________;
③容器Ⅳ、容器Ⅴ分别与容器Ⅰ相比实验条件不同,反应体系总压强随时间的变化如图所示。与容器Ⅰ相比,容器Ⅳ改变的实验条件是_____________________;容器Ⅴ与容器Ⅰ的体积不同,则容器Ⅴ中反应达到平衡时气体总压强(P )的范围是________。