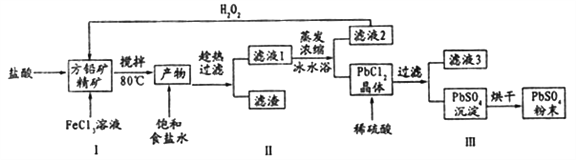
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如下:
已知:(i) PbCl2 (s)+2C1-(aq)=PbCl42-(aq) △H>0
(ii)有关物质的Ksp和沉淀时的pH如下:
物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
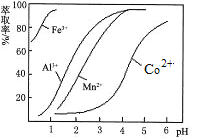
PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
PbCl2 | 1.6×10-5 | Pb(OH)2 | 6 | 7.04 |
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式___________。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因____________。
(3)在上述生产过程中可以循环利用的物质有______________。
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式________________。
(5)铅的冶炼、加工会使水体中重金属铅的含量增大造成严重污染。某课题组制备了一种新型脱铅剂(用EH表示),能有效去除水中的痕量铅,脱铅过程中主要发生的反应为:2EH(s)+Pb2+![]() E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
A.4~5 B.6~7 C.9~10 D.11~12
(6)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。

①放电过程中,Li+向_______移动(填“负极”或“正极”)。
②负极反应式为_____________。
③电路中每转移0.2mol电子,理论上生成_________g Pb。
【题目】根据下列实验现象所得出的结论正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生白色沉淀且不溶解 | 该溶液中一定含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
【题目】在一个容积不变的密闭容器中,发生反应:2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
(1)当n(NO):n(O2)=4:1时,O2的转化率随时间的变化关系如下图所示。

①A点的逆反应速率v逆(O2)_____B点的正反应速率v正(O2)(填“大于”、“小于”或“等于” )。
②NO的平衡转化率为______;当达到B点后往容器中再以4:1 加入些NO和 O2,当达到新平衡时,则NO的百分含量 B点NO的百分含量(填“大于”、“小于”或“等于” )。
③到达B点后,下列关系正确的是( )
A.容器内气体颜色不再变化 | B.v正(NO)="2" v正(O2) |
C.气体平均摩尔质量在此条件下达到最大 | D.容器内气体密度不再变化 |
(2)在下图1和图2中出现的所有物质都为气体,分析图1和图2,可推测:4NO(g)+3O2(g)=2N2O5(g) △H= 。


(3)降低温度,NO2(g)将转化为N2O4(g),以N2O4、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,Y为 ,有关石墨I电极反应式可表示为: 。