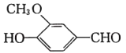
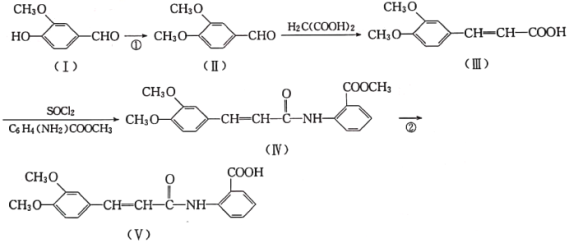
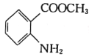
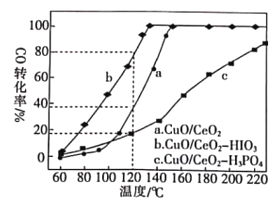
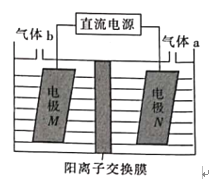
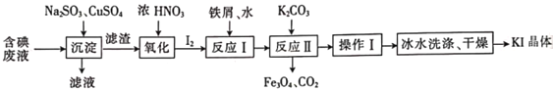
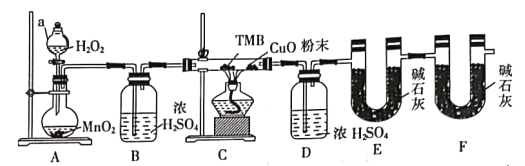
0 194216 194224 194230 194234 194240 194242 194246 194252 194254 194260 194266 194270 194272 194276 194282 194284 194290 194294 194296 194300 194302 194306 194308 194310 194311 194312 194314 194315 194316 194318 194320 194324 194326 194330 194332 194336 194342 194344 194350 194354 194356 194360 194366 194372 194374 194380 194384 194386 194392 194396 194402 194410 203614