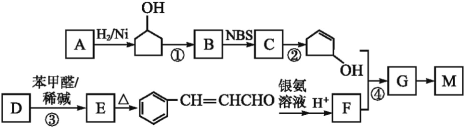
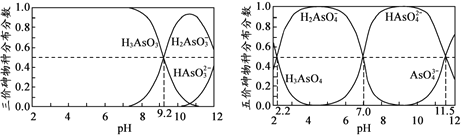
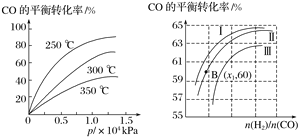
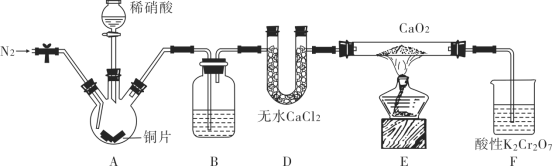
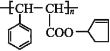【题目】已知,25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式 | CH3COOH | HCN | H2C2O4 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=5.9×10-2,K2=6.4×10-6 |
下列有关说法正确的是( )
A. CH3COOH溶液与Na2CO3反应生成CO2可以证明乙酸是弱酸
B. H2C2O4溶液的电离方程式为 H2C2O4![]() 2H+ + C2O42-
2H+ + C2O42-
C. 加水稀释HCN溶液,促进HCN的电离且c(CN-)/c(OH-)增大
D. 在Na2C2O4 溶液中加入足量的CH3COOH溶液发生反应的离子方程式为 C2O42- + CH3COOH=CH3COO- + HC2O4-