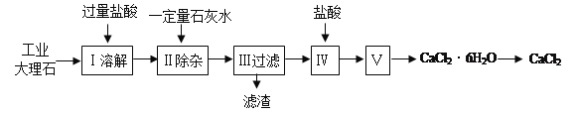
【题目】氯化钙常用于道路融冰剂和干燥剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al2O3、Fe2O3等杂质)制备氯化钙的主要流程如下:
 完成下列填空:
完成下列填空:
(1)上述使用的盐酸的物质的量浓度约为6.0mol/L,若用36.5%的盐酸(密度为1.2g/mL)配置6.0mol/L的盐酸100mL,所需的玻璃仪器有玻璃棒、量筒、胶头滴管、 ;需要量取36.5%的盐酸 mL;配制过程中,若其他操作都正确,下列操作会引起浓度偏小的是 。
A.定容摇匀后发现液面低于刻度线 |
B.定容时俯视容量瓶的刻度线 |
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作 |
D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线 |
(2)步骤Ⅰ中有关反应的离子方程式有: 、 、 。
(3)步骤Ⅱ控制石灰水用量的目的是防止(用离子方程式表示): 。
(4)滤渣的主要成分有(写化学式) 。
(5)步骤Ⅴ所含的操作依次是 、 。
(6)制得的氯化钙可以通过如下步骤测定其纯度:
①称取5.5g无水氯化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ 、 ;⑤称量。若得到4.3g碳酸钙,则氯化钙的质量分数为 ;若实验操作规范而测定结果偏低,其原因是 。



