【题目】某探究小组用HNO3 与大理石反应过程中质量减小的方法研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HN03 的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,在实验目的一栏中填出对应的实验编号:
试验编号 | T/K | 大理石规格 | HNO3浓度mol/L | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | 实验①和②探究HNO3 浓度对该反应速率的影响; (II)实验①和____探究温度对该反应速率的影响; (III)实验①和____探究大理石规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①中CO2质量随时间变化的关系见图:

依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70~90s范围内HNO3的平均反应速率_______。(忽略溶液体积变化)
(3)请在上图中,画出实验②和③中CO2质量随时间变化关系的预期结果示意图,并标出线的序号_______。
(4)工业上己实现CO2和H2反应生成甲醇的转化。己知:在一恒温、恒容密闭容器中充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。测得CO2和CH3OH (g)的浓度随时间变化如下图所示。请回答:
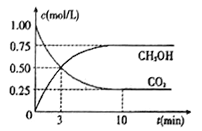
①达到平衡时H2的转化率为_______。在前10min内,用CO2表示的反应速率:V(CO2)=______mol/(L·min)
②能判断该反应达到化学平衡状态的依据是_______。
a.容器压强不变 b.混合气体中c(CO2)不变
c. v(CH3OH)=v(H2O) d. c(CH3OH)=c(H2O)
【题目】实验室用浓硫酸和乙醇反应制备乙烯,若温度过高或加热时间过长,制得的乙烯中往往混有CO2、SO2、H2O (气体少量)。请回答下列问题:
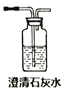
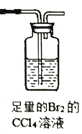
(1)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2、SO2、H2O(g)和乙烯,按气流的方向,各装置的连接顺序是:___________________。
(已知:SO2不能使Br2的CC14 溶液褪色)
① | ② | ③ | ④ | ⑤ |
|
|
|
|
|
(2)能说明有SO2的现象是_______。能说明有CO2的现象是____________。
(3)装置②中所加的试剂是___________,简述确定装置②在整套装置中的位置的理由是____。
(4)装置①的B中的酸性高锰酸钾溶液发生的炉子方程式为:_________。
(5)工业上用乙烯和水制取乙醇,该反应的类型为______反应。写出HCOOH和CH3CH218OH在浓硫酸作用下发生的化学方程式:___________________。