【题目】已知在298K和101kPa条件下,有如下反应:
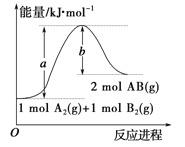
反应Ⅰ:C(s) + O2(g) = CO2(g) △ H1=-393.5 kJ·mol-1
反应Ⅱ:2C(s) + O2(g) = 2CO(g) △ H2=-221 kJ·mol-1
反应Ⅲ:N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
试回答下列问题:
(1)汽车尾气净化原理为反应Ⅳ:2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
(2)如果在一定温度下,体积为 2 升的密闭容器中发生化学反应Ⅳ,0~4min各物质物质的量的变化如下表所示:
物质(mol) 时间 | NO | CO | N2 | CO2 |
起始 | 0.40 | 1.0 | ||
2 min 末 | 2.0 | 0.80 | 1.6 | |
4 min 末 | 1.6 |
①求 0~2min 内用 CO 来表示的平均反应速率 v(CO)=________。
②试计算该温度下反应Ⅳ 的化学平衡常数 K=_________。
(3)若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L, c(N2)随时间 t 的变化曲线 x 如图所示。
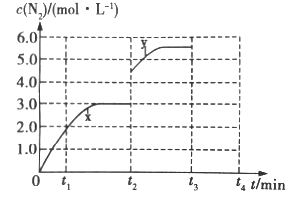
①若在 t2min时改变一个条件,c(N2)随反应时间 t 的变化如曲线 y 所示,则改变的条件是______。
②若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4 内 c(N2)的变化曲线______。
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
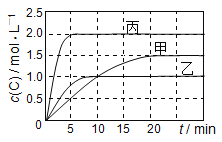
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
下列说法正确的是( )
A.平衡后,向甲容器中再充入0.5 mol A,A和B的转化率均增大
B.达到平衡时反应吸收的热量:Q丙> 2Q乙
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%