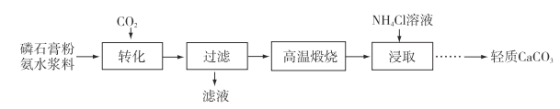
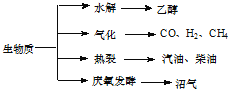
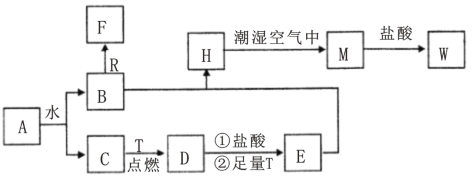
0 179810 179818 179824 179828 179834 179836 179840 179846 179848 179854 179860 179864 179866 179870 179876 179878 179884 179888 179890 179894 179896 179900 179902 179904 179905 179906 179908 179909 179910 179912 179914 179918 179920 179924 179926 179930 179936 179938 179944 179948 179950 179954 179960 179966 179968 179974 179978 179980 179986 179990 179996 180004 203614