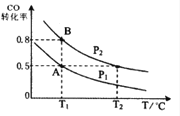
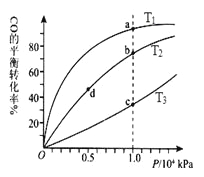
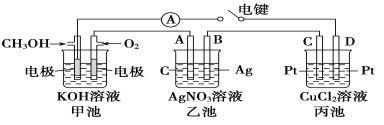
0 178138 178146 178152 178156 178162 178164 178168 178174 178176 178182 178188 178192 178194 178198 178204 178206 178212 178216 178218 178222 178224 178228 178230 178232 178233 178234 178236 178237 178238 178240 178242 178246 178248 178252 178254 178258 178264 178266 178272 178276 178278 178282 178288 178294 178296 178302 178306 178308 178314 178318 178324 178332 203614