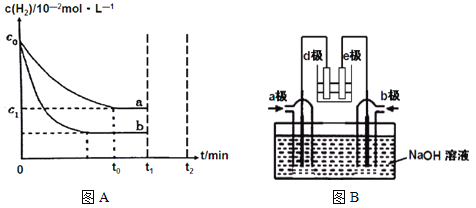
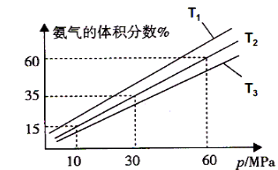
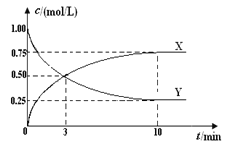
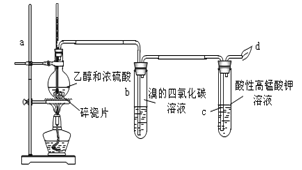
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 最外层电子数比内层电子总数少4 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 与氢形成的气态化合物在标准状况下的密度为0.76g·L-1 |
Z | 元素最高正价与负价的绝对值之差是6 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是 ,在周期表中的位置是 。
(2)元素Y与氢元素形成一种离子YH4+,写出该离子与Z离子形成化合物的电子式 。
(3)写出元素X、T形成的化合物XT2的电子式 。
(4)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.与铁加热,Z生成三价铁,T生成二价铁
e.T原子与Z原子电子层数相同,Z原子半径小于T原子
(5)T的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(6)分别用电子式表示Z与镁元素、Y与氮元素形成化合物的过程: 。