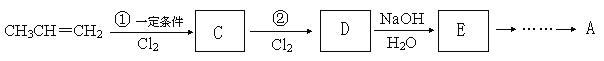
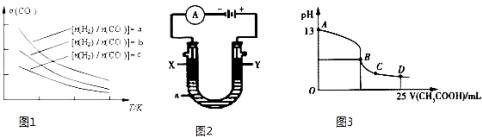
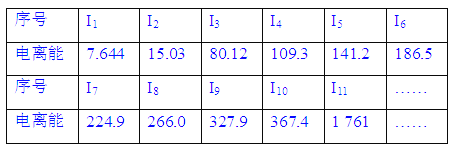
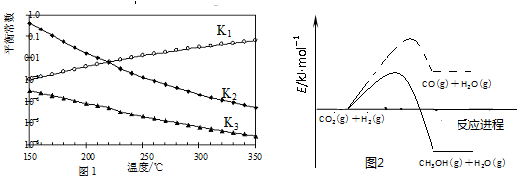
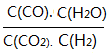0 178016 178024 178030 178034 178040 178042 178046 178052 178054 178060 178066 178070 178072 178076 178082 178084 178090 178094 178096 178100 178102 178106 178108 178110 178111 178112 178114 178115 178116 178118 178120 178124 178126 178130 178132 178136 178142 178144 178150 178154 178156 178160 178166 178172 178174 178180 178184 178186 178192 178196 178202 178210 203614