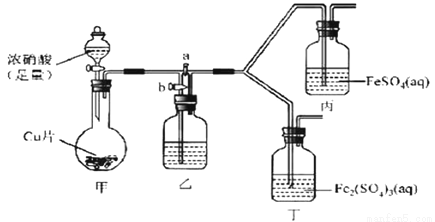
0 176062 176070 176076 176080 176086 176088 176092 176098 176100 176106 176112 176116 176118 176122 176128 176130 176136 176140 176142 176146 176148 176152 176154 176156 176157 176158 176160 176161 176162 176164 176166 176170 176172 176176 176178 176182 176188 176190 176196 176200 176202 176206 176212 176218 176220 176226 176230 176232 176238 176242 176248 176256 203614


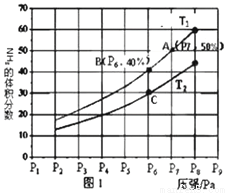
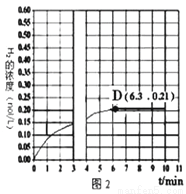
 2NH3(g)合成氮气。对于气相反应,用某组份(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作Kp),且PB=P×B的体积分数。则该反应的化学平衡常数表达式(Kp)是_____。恒温恒压下,在一容积可变的容器中,该反应达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡_________移动(填“正向”、“逆向”或“不”)。
2NH3(g)合成氮气。对于气相反应,用某组份(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作Kp),且PB=P×B的体积分数。则该反应的化学平衡常数表达式(Kp)是_____。恒温恒压下,在一容积可变的容器中,该反应达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡_________移动(填“正向”、“逆向”或“不”)。