苯甲酸乙酯可用作食用香料。某小组用如下装置制备苯甲酸乙酯
反应原理: (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O
产物和部分反应物相关数据如下:
物质 | 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
熔点/℃ | 122.1 | -117.3 | -34.6 |
沸点/℃ | 249 | 78.3 | 213 |

实验步骤:
①在B中加入的物质有:12.2g苯甲酸、10mL乙醇、10mL浓硫酸和沸石;
②按图甲安装好仪器,水浴加热,回流2小时;
③冷却后将B中液体与30mL水混合,并分批加入碳酸钠粉末;
④分液,取出有机层并加入适量MgSO4摇匀;
⑤按图乙装置安好仪器,加热精馏④所得有机物,收集产品。
回答下列问题:
(1)仪器C的名称______________。
(2)步骤① 若加热后才发现未加沸石,应采取的措施是________;步骤② 采取水浴加热的优点是______。
(3)步骤③ 为了预防液体因瞬时放出大量热而飞溅,将有机物与水混合的操作是____________。
(4)步骤④分液时除了要用到烧杯,还需要的主要玻璃仪器有__________,使用该仪器之前需要进行的操作是__________;无水MgSO4的作用是___________。
(5)步骤⑤收集馏分应控制的最佳温度为____________。
(6)为了提高苯甲酸乙酯的产率,可以采取的措施_________(任填一种)。
氯化亚铜广泛应用于有机合成。工业上以低品位铜矿(主要含CuS、Fe2O3、SiO2)为原料,
制备氯化亚铜的生产工艺如下:
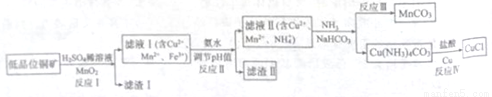
(1)CuS中Cu的化合价为_____________。
(2)滤渣Ⅰ的成分除S之外还有__________,反应Ⅰ中MnO2的作用是______________
(3)已知生成氢氧化物的pH如下表:
沉淀物 | Fe(OH)3 | Mn(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.7 | 8.3 | 4.2 |
完全沉淀的pH | 3.2 | 9.8 | 6.7 |
则反应Ⅱ中用氨水调节pH值的范围是________________。
(4)检验滤液Ⅱ中是否含有Fe3+的试剂是____________。
(5)请用化学用语回答:
①反应中Ⅲ生成难溶MnCO3的离子方程式_____________;
②反应Ⅳ素所对应的化学方程式____________________。
(6)氯化亚铜的定量分析:
步骤Ⅰ.称取0.2500g的样品和10.0mL 1.0mol/L的FeCl3溶液置于250mL锥形瓶中,不断摇动;
步骤Ⅱ.待样品溶解后,加水10.0mL和3滴指示剂;
步骤Ⅲ.用0.1000mol/L CeOSO4标准溶液滴至终点,并记录读数。重复实验两次,测得数据如下:
序号 | 1 | 2 | 3 |
起始读数 | 0.95mL | 0.70mL | 1.00mL |
终点读数 | 20.95mL | 24.95mL | 21.00mL |
已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+
①数据处理:计算CuCl纯度________________;
②误差分析:下列操作会使滴定结果偏高的是__________________。
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线,其他操作正确
C.0.1000mol/L CeOSO4溶液久置后浓度变小
D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
E.所取FeCl3溶液体积偏大



 先增大后减小
先增大后减小 NH2COONH4(s) ΔH1=-159.50kJ·mol-1
NH2COONH4(s) ΔH1=-159.50kJ·mol-1
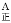 _______v
_______v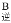 (填“>”“<”或“=”)。当温度升高时,平衡常数K1值的变化趋势为__________,在B点氨气的转化率为_________;
(填“>”“<”或“=”)。当温度升高时,平衡常数K1值的变化趋势为__________,在B点氨气的转化率为_________;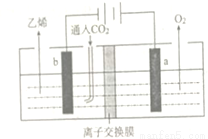

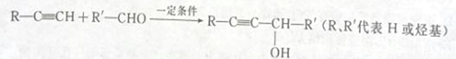
 _________________。
_________________。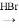 CH3CH2Br
CH3CH2Br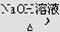 CH3CH2OH
CH3CH2OH 和
和 说法中正确的是( )
说法中正确的是( )