0 15136 15144 15150 15154 15160 15162 15166 15172 15174 15180 15186 15190 15192 15196 15202 15204 15210 15214 15216 15220 15222 15226 15228 15230 15231 15232 15234 15235 15236 15238 15240 15244 15246 15250 15252 15256 15262 15264 15270 15274 15276 15280 15286 15292 15294 15300 15304 15306 15312 15316 15322 15330 203614
 3C(g),起始时按5:2的体积比把A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使之反应,达平衡时混合气体中C的体积分数为60%,求:
3C(g),起始时按5:2的体积比把A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使之反应,达平衡时混合气体中C的体积分数为60%,求: 2XY2
2XY2  X2Y
X2Y  2X3Y
2X3Y 2XY3
2XY3  C(气)+ D(气) 5 min后达到平衡。已知各物质的平衡浓度的关系为:[A]a [B] = [C][D],若在温度不变情况下将容器的体积扩大为原来的10倍,其A的转化率不发生变化,则B的转化率为
C(气)+ D(气) 5 min后达到平衡。已知各物质的平衡浓度的关系为:[A]a [B] = [C][D],若在温度不变情况下将容器的体积扩大为原来的10倍,其A的转化率不发生变化,则B的转化率为 2SO3(g)平衡体系中: n (SO2) =2.0 mol/L , n(O2) = 0.8 mol/L, n (SO3)=2.4 mol/L ,则 SO2 的起始浓度的范围为
2SO3(g)平衡体系中: n (SO2) =2.0 mol/L , n(O2) = 0.8 mol/L, n (SO3)=2.4 mol/L ,则 SO2 的起始浓度的范围为  xC(g),2 min时反应达到平衡状态(温度不变),剩余0.8 mol B,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g),2 min时反应达到平衡状态(温度不变),剩余0.8 mol B,并测得C的浓度为0.4mol/L,请填写下列空白: 2C(g)+D(g)
2C(g)+D(g)  PCl5(g),平衡时容器内压强为开始时的6/7。计算并回答
PCl5(g),平衡时容器内压强为开始时的6/7。计算并回答 )
)  Si(s)+4HCl(g);△H=+QkJ·mol-1 (Q>0)。某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是
Si(s)+4HCl(g);△H=+QkJ·mol-1 (Q>0)。某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是  2O(g) ΔH=a kJ·mol-1;NO2(g)
2O(g) ΔH=a kJ·mol-1;NO2(g)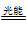 NO(g)+O (g) ΔH=b kJ·mol-1;
NO(g)+O (g) ΔH=b kJ·mol-1;
 2NO(g)+O2(g) 在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在
2NO(g)+O2(g) 在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在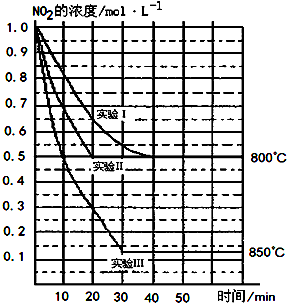
 B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: