0 14676 14684 14690 14694 14700 14702 14706 14712 14714 14720 14726 14730 14732 14736 14742 14744 14750 14754 14756 14760 14762 14766 14768 14770 14771 14772 14774 14775 14776 14778 14780 14784 14786 14790 14792 14796 14802 14804 14810 14814 14816 14820 14826 14832 14834 14840 14844 14846 14852 14856 14862 14870 203614
 2NH3(g) △H<0
2NH3(g) △H<0 

 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因用化学平衡移动的理论进行解释是_________________________________。
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因用化学平衡移动的理论进行解释是_________________________________。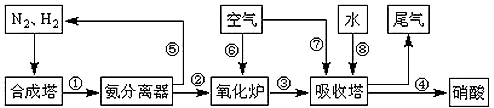
 CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=________(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=________(填计算结果)。 2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1_______300℃(填“>”、“<”或“=”)。
2NH3(g)△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1_______300℃(填“>”、“<”或“=”)。 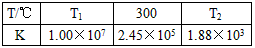
 2NH3(g) △H<0,下图是合成氨的简要流程示意图
2NH3(g) △H<0,下图是合成氨的简要流程示意图
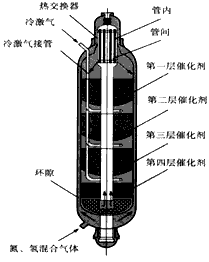
 2NH3(g) △H<0,当压强为30MPa,温度为500℃时,在容积为1L的密闭容器中充入1molN2和3molH2,反应达到平衡时NH3的体积分数为20%,求此时的平衡常数________。
2NH3(g) △H<0,当压强为30MPa,温度为500℃时,在容积为1L的密闭容器中充入1molN2和3molH2,反应达到平衡时NH3的体积分数为20%,求此时的平衡常数________。

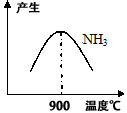
 2NH3(g),分别在不同时测定NH3的含量,然后绘制出下图
2NH3(g),分别在不同时测定NH3的含量,然后绘制出下图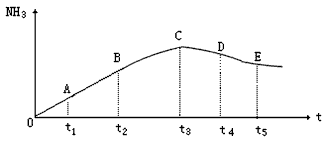
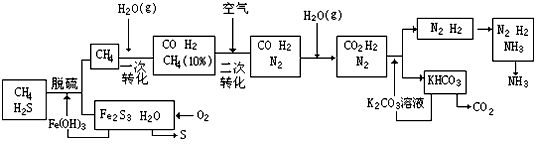

 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑  2NH3
2NH3 
