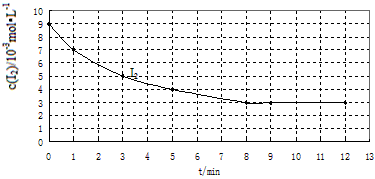
0 14256 14264 14270 14274 14280 14282 14286 14292 14294 14300 14306 14310 14312 14316 14322 14324 14330 14334 14336 14340 14342 14346 14348 14350 14351 14352 14354 14355 14356 14358 14360 14364 14366 14370 14372 14376 14382 14384 14390 14394 14396 14400 14406 14412 14414 14420 14424 14426 14432 14436 14442 14450 203614

 MnCl2+Cl2↑+2H2O,请在该反应方程式中标出电子转移方向和数目,
MnCl2+Cl2↑+2H2O,请在该反应方程式中标出电子转移方向和数目,


 等杂质)生产医药级二水合氯化钙(
等杂质)生产医药级二水合氯化钙( 的质量分数为97.0%~103.0%)的主要流程如下
的质量分数为97.0%~103.0%)的主要流程如下
 。检验
。检验 是否沉淀完全的试验操作是___________________。
是否沉淀完全的试验操作是___________________。  转化为
转化为 ;
;  在蒸发时水解;
在蒸发时水解; 含量的方法是:
含量的方法是: 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积的平均值为20.39mL。
溶液体积的平均值为20.39mL。  的质量分数为___________________。
的质量分数为___________________。  的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________________;___________________。
的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________________;___________________。 
 2HI (g) △H<0 反应速率的影响,设计下表所示实验
2HI (g) △H<0 反应速率的影响,设计下表所示实验