题目内容
【题目】【山西省实验中学2017届下学期模拟热身】[化学―选修3:物质结构与性质]
研究物质的微观结构,有助于人们理解物质变化的本质。请根据已学习的物质结构知识,回答下列问题:
(1)基态Mn原子的价电子排布式为___,气态Mn2+再失去l个电子比Fe2+再失去1个电子更难,其原因是________。
(2)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有_____。写出难溶物溶于氨水时的离子方程式__________。实验过程中加入C2H5OH 后可观察到析出深蓝色Cu(NH3)4SO4·5H2O晶体。实验中所加C2H5OH 的作用是______。
(3)HClO2、HClO3为氯元素的含氧酸,试推测ClO2-的空间结构:________;HClO3分子中,Cl原子的杂化方式为______;两种酸酸性较强的是_______.
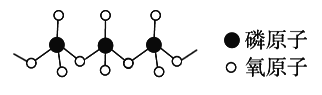
(4)多磷酸盐的酸根阴离子是由两个或两个以上磷氧四面体通过共用角顶氧原子而连接起来的,部分结构如图所示,多磷酸根离子的通式为______。(磷原子数目用n表示)
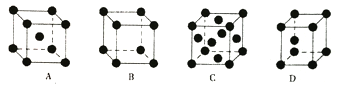
(5)金属Pt采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________。
已知金属Pt的密度为21.4 g/cm3,则Pt原子半径的计算式为______pm (只列式,不必计算结果,Pt的相对原子质量为M,阿伏加德罗常数为6.02×1023mol-1)。
【答案】3d54s2 Mn2+转化为Mn3+,3d能级由半满到3d4,而Fe2+转化为Fe3+,3d能级由3d6到半满,能级半满时为稳定结构 共价键、配位键 Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O 降低Cu(NH3)4SO4的溶解度 V形 sp3杂化 HClO3 [PnO3n+1](n+2)- C ![]()
【解析】(l)锰为25号元素,基态Mn原子的价电子排布式为3d54s2,气态Mn2+的3d为半充满结构,较为稳定,Fe2+的3d不是稳定结构,因此Mn2+失去l个电子比Fe2+再失去1个电子更难,故答案为:3d54s2;Mn2+转化为Mn3+,3d能级由半满到3d4,而Fe2+转化为Fe3+,3d能级由3d6到半满,能级半满时为稳定结构;
(2)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物氢氧化铜沉淀,继续加氨水,难溶物溶解,得到深蓝色的透明溶液,发生的反应为Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O;在[Cu(NH3)4]2+中含有共价键、配位键;加入极性较小的溶剂(如乙醇),可以降低Cu(NH3)4SO4的溶解度,从而析出深蓝色的Cu(NH3)4SO4·5H2O晶体,故答案为:共价键、配位键;Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O;降低Cu(NH3)4SO4的溶解度;
(3)ClO2-中Cl原子的价层电子对数为2+![]() ×(7+12×2)=4,采用sp3杂化,空间结构为V形;HClO3中Cl原子的孤对电子数为
×(7+12×2)=4,采用sp3杂化,空间结构为V形;HClO3中Cl原子的孤对电子数为![]() ×(7+12×3)=1,价层电子对数=4,杂化轨道类型为sp3杂化; HClO3的非羟基氧原子数目比HClO2多,酸性较强,
×(7+12×3)=1,价层电子对数=4,杂化轨道类型为sp3杂化; HClO3的非羟基氧原子数目比HClO2多,酸性较强,
故答案为:V形;sp3;HClO3;
(4)由给出的多聚磷酸根结构式知,含有n个多聚磷酸根离子,相当于是n个磷酸根离子中去掉了(n-1)氧原子,所带电荷为-2×(3n+1)+5n=-(n+2),由化合价规则知多磷酸根离子的通式为:[PnO3n+1](n+2)-;故答案为:[PnO3n+1](n+2)-;
(5)金属Pt采用“…ABCABC…”型堆积方式,为立方面心结构,因此选C;每个金晶胞中含有的原子个数=8×![]() +6×
+6×![]() =4,设半径为r,则一个晶胞的体积为(2
=4,设半径为r,则一个晶胞的体积为(2![]() r)3,(2
r)3,(2![]() r)3×6.02×1023×21.4g/cm3 =M×4g,解得:r=
r)3×6.02×1023×21.4g/cm3 =M×4g,解得:r=![]() pm,故答案为:C;
pm,故答案为:C;![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】向盛有H2O2溶液的试管中滴入少量浓盐酸,经检验生成的混合气体中只含有O2、Cl2、HCl和水蒸气.将气体通入X溶液(如图),依据观察到的现象,能判断气体中含有Cl2的是( )
选项 | X溶液 | 现象 |
|
A | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 | |
B | 滴有KSCN的FeSO4溶液 | 溶液变为血红色 | |
C | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
D | 紫色石蕊溶液 | 溶液先变红后褪色 |
A. A B. B C. C D. D









