��Ŀ����
����Ŀ����Ϊ��������VA��Ԫ�أ�����ʪ��ұ��ӻ����Bi2S3��Bi��Bi2O3�ȣ���ȡ������Ĺ�����������ͼ��ʾ��
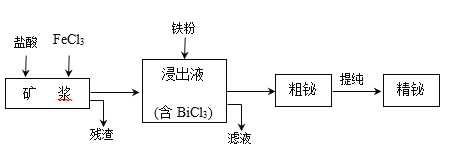
��֪��BiCl3ˮ������ӷ���ʽΪ��BiCl3+H2O![]() BiOCl+2H+��2Cl��
BiOCl+2H+��2Cl��
��1������ʱ���������������____��
��2������ʱ��Bi����FeCl3��Һ�Ļ�ѧ����ʽΪ____��
��3�������к���һ�ֵ��ʣ��õ�����_______��
��4����Һ����Ҫ�����ǣ���ѧʽ��_____�������ʿ��ڹ�����ת��Ϊѭ�����õ�ԭ�ϣ�ת���ķ�Ӧ����ʽΪ____��
��5����������к���Ag2S���������ܽ��������Һ����Ԫ����______���ѧʽ����������С�
��6�������⾫��ʱӦ����_______����
��7��ij�¶��±��͵�Ag2S��Һ�У������ӵ�Ũ��Ϊ10-4mol/L����Ag2S��KSP=5.8��10-39�������Һ�������ӵ�Ũ��Ϊ___________��
���𰸡�Ϊ������BiCl3ˮ�⣬������Ԫ�ص���� Bi+3FeCl3��BiCl3+3FeCl2 S �Ȼ����� 2FeCl2+Cl2��2FeCl3 AgCl �� 5.8��10-31
��������
��1�����к�Bi2S3������FeCl3��Һ���������������ԣ�����������Ϊ���ʣ���ӦΪ��Bi2S3+6FeCl3=2BiCl3+6FeCl2+3S��BiCl3ˮ������ӷ���ʽΪ��BiCl3+H2O![]() BiOCl+2H+��2Cl����ӦҺ���뱣��ǿ���ԣ�������Ԫ�ػ���BiOCl����ʽ�Ȼ��飩��ʽ���������ʹ���ʽ��ͣ���˼���������Ϊ������BiCl3ˮ�⣬������Ԫ�ص���ġ����������ͬʱ�����ܽ�Bi2O3�ȡ�
BiOCl+2H+��2Cl����ӦҺ���뱣��ǿ���ԣ�������Ԫ�ػ���BiOCl����ʽ�Ȼ��飩��ʽ���������ʹ���ʽ��ͣ���˼���������Ϊ������BiCl3ˮ�⣬������Ԫ�ص���ġ����������ͬʱ�����ܽ�Bi2O3�ȡ�
��2��Bi����FeCl3��Һ���ֳ���ԭ�ԣ�Bi+3FeCl3��BiCl3+3FeCl2��
��3����ϣ�1���ķ�������֪�����еĵ�����S��
��4����BiCl3��Һ�м������ۣ������û���Ӧ������Bi3+��ԭΪBi�����������������ӣ�2Bi3++3Fe=3Fe2++2Bi����Һ����Ҫ�������Ȼ��������Ȼ��������ڹ�����ת��Ϊѭ�����õ�ԭ�ϣ���������м�������ʿ�֪ת��Ϊ�Ȼ����������ķ�Ӧ��2FeCl2+Cl2��2FeCl3��
��5����������к���Ag2S��-2��������������S���ʣ�������������е�Cl��Ag+�������AgCl��������С�
��6�������ᴿ���ƴ�ͭ�ľ���������Ӧ����������
��7��Ag2S��KSP= ![]() ����֪��Һ�������ӵ�Ũ�ȣ��������ӵ�Ũ��Ϊ
����֪��Һ�������ӵ�Ũ�ȣ��������ӵ�Ũ��Ϊ![]() ��
��

 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�����Ŀ������ʵ�鷽���ܴﵽʵ��Ŀ�ĵ��ǣ����ּг�װ������ȥ��
|
|
|
|
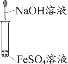
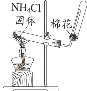
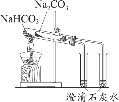
A֤���������Ա� ����ǿ | Bʵ������ ���������� | Cʵ�����ư��� | D֤��̼���������ȶ� �Ա�̼������ |
A.AB.B��C.CD.D