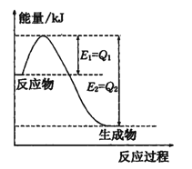
题目内容
【题目】(1)下图是自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中的实验完全相同。回答下列问题:
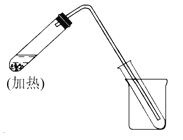
①左边大试管中要加入几片碎瓷片,其作用是 。
②该装置中使用的玻璃导管较长,其作用是 。
③烧杯中还要盛有的物质是 。
(2)如下图所示a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体。

①A与 组合,用于 ,②B与 组合,用于 ,
③B与 组合,用于 ,④D与 组合,用于 。
【答案】(1)①防止暴沸; ②导气兼冷凝; ③冰(冷)水;
(2)①c 制取气体;②b分液;③d 过滤;④d 添加酒精
【解析】
试题分析:①液态混合物加热,为了防止液面剧烈跳动,要加入碎瓷片,因此左边大试管中要加入几片碎瓷片,其作用是防止暴沸;②该装置中使用的玻璃导管较长,一方面是使产生的水蒸气通过导管进入到右侧的试管中,另一方面是利用空气的温度低于水蒸气的温度,使其充分冷凝转化为液体水,故导气管的作用是导气兼冷凝的作用;③为了使水蒸气快速冷凝降温,在盛有接水蒸气的试管中要加入冷却水或冰水予以降温;(2)①A与c 组合可用于用H2O2和MnO2混合制取O2气体;②B与b组成分液漏斗,可进行分液操作;③B与d组合形成普通的过滤装置,进行过滤操作;④D与d组合,可组成向酒精灯中添加酒精的操作。

练习册系列答案
相关题目