题目内容
18.下列说法正确的是( )| A. | 二氧化氮中混有一氧化氮杂质,可通入氧气将一氧化氮转化为二氧化氮 | |
| B. | 过量的铜与浓硝酸反应一定有一氧化氮生成 | |
| C. | Fe与S混合加热生成FeS2 | |
| D. | 工业上利用氨气制硝酸属于人工固氮 |
分析 A.引入新的杂质气体氧气;
B.硝酸浓度降低时生成NO;
C.Fe与S混合加热生成FeS;
D.固氮应为氮气生成化合物.
解答 解:A.一氧化氮和氧气反应生成二氧化氮,一氧化氮中混有二氧化氮杂质,通入氧气可将一氧化氮转化为二氧化氮,但引入新的杂质气体氧气,故A错误;
B.过量的铜与浓硝酸反应,随着反应的进行,硝酸的浓度逐渐减小,稀硝酸与铜反应生成一氧化氮,故B正确;
C.S具有弱氧化性,Fe与S混合加热生成FeS,故C错误;
D.固氮应为氮气生成化合物,故D错误.
故选B.
点评 本题主要考查了元素化合物知识,侧重考查了氮的氧化物的性质,掌握一氧化氮、二氧化碳、合成氨原理是解答的关键,题目难度不大.

练习册系列答案
相关题目
8.一定温度下向2L恒溶密闭容器中加入0.2molNO和0.1molCl2,发生反应2NO(g)+Cl2(g)?2ClNO(g)△H,10min后反应达到平衡,测得n(Cl2)=2.5×10-2mol.下列说法错误的是( )
| A. | 0-10min的平均反应速率:n(ClNO)=7.5×10-3mol•L-1•min-1 | |
| B. | 平衡时NO的转化率为75% | |
| C. | 其它条件保持不变,反应若在恒压条件下进行,平衡时NO的转化率变大 | |
| D. | 升高温度,反应的平衡常数减小,则△H>0 |
13.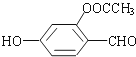 已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )
已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )
 已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )
已知醛基能发生如下反应:2-CHO+OH-→CH2OH+COO-.则1mol如图所示的有机物与足量的NaOH溶液作用后,最多消耗NaOH的物质的量为( )| A. | 2.5mol | B. | 3mol | C. | 3.5 mol | D. | 4 mol |
3. 用如图所示装置进行下列实验,实验结果与预测现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测现象不一致的是( )
 用如图所示装置进行下列实验,实验结果与预测现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测现象不一致的是( )| 选项 | ①中物质 | ②中物质 | 预测①中现象 |
| A | 酚酞溶液 | 浓氨水 | 无色变红色 |
| B | 湿润红布条 | 饱和氯水 | 红布条褪色 |
| C | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
| D | 硝酸银溶液 | 浓盐酸 | 有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
10.下列说法正确的是( )
| A. | 25℃时 NH4Cl 溶液的 KW 大于 100℃时 NaCl 溶液的 KW | |
| B. | SO2 通入碘水中,反应的离子方程式为 SO2+I2+2H2O═SO32-+2I-+4H+ | |
| C. | 加入铝粉能产生 H2 的溶液中,可能存在大量的 Na+、Ba2+、AlO2-、NO3- | |
| D. | 100℃时,将 pH=2 的盐酸与 pH=12 的 NaOH 溶液等体积混合,溶液显中性 |
7.如表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)上述元素A、B、D、E、F中形成化合物种类最多的一种元素的原子结构示意图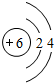
(2)稳定性比较:D的氢化物>G的氢化物(填“大于”“等于”或“小于)
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为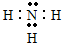
(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式Cl+H2O=H++Cl-+HClO
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为N≡N.
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
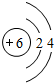
(2)稳定性比较:D的氢化物>G的氢化物(填“大于”“等于”或“小于)
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
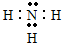
(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式Cl+H2O=H++Cl-+HClO
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为N≡N.
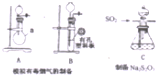 某化工厂排放了大量有毒气体,其主要成分是SO2、CO2、N2和O2,某研究性学习小组在实验室利用右图装置制备模拟有毒烟气,同时利用模拟有毒烟气中的SO2制取硫代硫酸钠晶体(Na2S2O3•5H2O),并进一步实验测定该晶体的纯度.查阅资料得知:①将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3•5H2O;②KI3溶液为碘单质的碘化钾溶液;③硫代硫酸钠(Na2S2O3)具有较强的还原性,回答下列问题:
某化工厂排放了大量有毒气体,其主要成分是SO2、CO2、N2和O2,某研究性学习小组在实验室利用右图装置制备模拟有毒烟气,同时利用模拟有毒烟气中的SO2制取硫代硫酸钠晶体(Na2S2O3•5H2O),并进一步实验测定该晶体的纯度.查阅资料得知:①将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O3•5H2O;②KI3溶液为碘单质的碘化钾溶液;③硫代硫酸钠(Na2S2O3)具有较强的还原性,回答下列问题: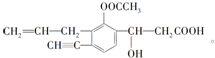
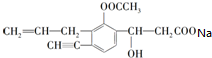 +CO2↑+H2O.
+CO2↑+H2O. X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高.Z 的氧化物是常见的两性氧化物;R 基态原子最外层成对电子的数目和未成对电子 的数目相等.
X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高.Z 的氧化物是常见的两性氧化物;R 基态原子最外层成对电子的数目和未成对电子 的数目相等.