题目内容
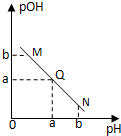
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH = -lg[OH-])与pH的变化关系如图所示,则

A.M点所示溶液导电能力强于Q点
B.N点所示溶液中c(CH3COO-)﹥c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
【答案】
C
【解析】开始时溶液呈酸性,pH较小,溶液中的溶质为醋酸,当加入少量氢氧化钠溶液的M点,溶液中的溶质为醋酸和少量的醋酸钠;Q点时溶液中有较多的醋酸钠和少量的醋酸,由于醋酸是弱电解质,故Q点的导电能力强于M点,A错;N点溶液中溶质为醋酸钠和过量的氢氧化钠,此时溶液显碱性,溶液中c(CH3COO-)<c(Na+),B错;M点时,pOH=b,则溶液中的[OH-]=10-bmol/L,由于溶液显酸性,溶液中电离的水为:10-bmol/L,N点时,pH=b,则溶液中的[H+]=10-bmol/L,由于溶液显碱性,溶液中电离的水为:10-bmol/L,水的电离程度相同,C对;由于醋酸和氢氧化钠等浓度,等体积混合时,两者恰好完全反应,溶液中的溶质为醋酸钠,溶液显碱性;但是Q点pOH=pH时,溶液恰好呈中性,不符合,D错。
【考点定位】此题考查了电解质之间的反应、溶液的pH、水的电离等知识和考生对新信息的理解能力。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )| A、M点所示溶液导电能力强于Q点 | B、N点所示溶液中c(CH3COO-)>c(Na+) | C、M点和N点所示溶液中水的电离程度相同 | D、Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
 某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH( pOH=-lgc(OH-))与pH的变化关系如图所示,则( )
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH( pOH=-lgc(OH-))与pH的变化关系如图所示,则( )| A、N点所示溶液中c(H+)<c(OH-) | B、M点所示溶液导电能力强于Q点 | C、M点水的电离程度大于N点 | D、Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |


