题目内容
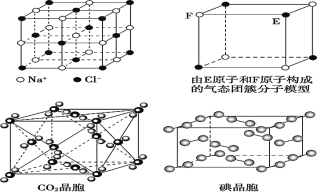
【题目】下图表示一些晶体中的某些结构,请回答下列问题:
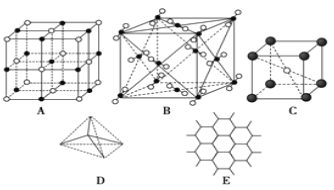
(1)代表金刚石的是(填编号字母,下同)_____,其中每个碳原子与_____个碳原子最近且距离相等。
(2)代表石墨的是_____,每个正六边形占有的碳原子数平均为_____个。
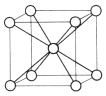
(3)代表 NaCl 的是_________,每个Na+周围与它最近且距离相等的Cl-有_____个。
(4)代表 CsCl 的是_____,每个Cs+与_____个Cl-紧邻。
(5)代表干冰的是_____,每个 CO2 分子与_____个 CO2 分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为_____。
【答案】D 4 E 2 A 6 C 8 B 12 石墨>金刚石>NaCl>CsCl>干冰
【解析】
先根据不同晶体的结构特点确定图形所代表的物质。金刚石的基本单元是正四面体,为空间网状结构,石墨是层状结构,NaCl晶胞是简单的立方晶胞,氯离子的配位数是6,氯化铯的配位数是8,干冰是分子晶体,各种物质的熔点关系为原子晶体>离子晶体>分子晶体,利用均摊法可以进行晶胞的计算。
(1)金刚石是空间网状结构,每个碳原子连接4个碳原子,形成四面体单元结构,原子间以共价键相结合,属于原子晶体,故选D;
(2)石墨是层状结构,其晶体中碳原子呈平面正六边形排列,每个正六边形占有的碳原子数平均=1×1/3×6=2,故选E;
(3)NaCl是离子晶体,其构成微粒是阴阳离子,NaCl晶胞是简单的立方单元,阴阳离子间通过离子键结合,氯离子和钠离子的配位数都是6,每个钠离子周围有6个氯离子,故选A;
(4)CsCl是由阴阳离子构成的,氯离子和铯离子的配位数是8,故选C;
(5)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上,所以图B为干冰晶体,故选B;
(6)晶体熔沸点:原子晶体>离子晶体>分子晶体,离子晶体熔沸点与离子半径成正比,与电荷成正比,金刚石是原子晶体、NaCl和CsCl是离子晶体、干冰是分子晶体、石墨是混合型晶体,根据配位数及晶胞结构知,A、B、C、D、E分别是NaCl、干冰、CsCl、金刚石、石墨,钠离子半径小于铯离子半径,石墨中C-C键长小于金刚石中C-C键长,所以这几种晶体熔点高低顺序是E>D>A>C>B,即:石墨>金刚石>NaCl>CsCl>干冰。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案