题目内容
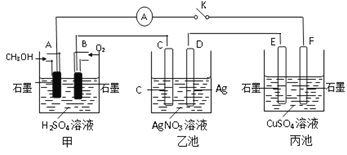
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的开关时,观察到电流表的指针发生了偏转。
请回答下列问题:
(1)甲池为_____(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为_________________________。
(2)乙池中C(石墨)电极的名称为____(填“正极”“负极”或“阴极”“阳极”),总反应的化学方程式为_________________________。
(3)当乙池中D极质量增加5.4g时,甲池中理论上消耗O2的体积为_____mL(标准状况),转移的电子数为__________
(4)丙池中_____(填“E”或“F”)极析出铜。
(5)若丙中电极不变,将其溶液换成NaCl溶液,开关闭合一段时间后,丙中溶液的pH将_____(填“增大”“减小”或“不变”)。
【答案】原电池 CH3OH-6e-+H2O = CO2+6H+ 阳极 4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3 280 0.05NA F 增大
4Ag+O2↑+4HNO3 280 0.05NA F 增大
【解析】
从图中可以看出,甲池为原电池,A电极为负极,B电极为正极。与B电极相连的C电极为阳极,D电极为阴极,E电极为阳极,F电极为阴极。
(1)由以上分析知,甲池为原电池,通入CH3OH电极为负极,在酸性溶液中,CH3OH失电子生成CO2和H+,电极反应式为CH3OH-6e-+H2O = CO2+6H+。答案为:原电池;CH3OH-6e-+H2O = CO2+6H+;
(2)乙池中C(石墨)电极与正极相连,为电解池的阳极,在该电池中,Ag+得电子,H2O失电子,生成Ag、O2和H+,总反应的化学方程式为4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3。答案为:阳极;4AgNO3+2H2O
4Ag+O2↑+4HNO3。答案为:阳极;4AgNO3+2H2O ![]() 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
(3)当乙池中D极质量增加5.4g时,n(Ag)=![]() =0.05mol,n(e-)=0.05mol,甲池中理论上消耗O2的体积为
=0.05mol,n(e-)=0.05mol,甲池中理论上消耗O2的体积为![]() =280mL(标准状况),转移的电子数为0.05NA。答案为:280;0.05NA;
=280mL(标准状况),转移的电子数为0.05NA。答案为:280;0.05NA;
(4)丙池中,阴极为F极析出铜。答案为:F;
(5)若丙中电极不变,将其溶液换成NaCl溶液,则电解反应方程式为2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,丙中溶液的pH将增大。答案为:增大。
2NaOH+Cl2↑+H2↑,丙中溶液的pH将增大。答案为:增大。

 字词句段篇系列答案
字词句段篇系列答案