题目内容
在碘化钾和硫酸的混合溶液中加入过氧化氢水溶液,迅速发生反应放出大量气体,反应过程可表示如下:
①H2O2+2KI+H2SO4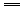 I2+K2SO4+2H2O
I2+K2SO4+2H2O
②H2O2+I2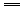 2HIO
2HIO
③H2O2+2HIO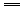 I2+O2↑+2H2O
I2+O2↑+2H2O
(1)H2O2在反应③中的作用是
[ ]
|
A.氧化剂 |
B.还原剂 |
|
C.既是氧化剂又是还原剂 |
D.既不是氧化剂也不是还原剂 |
(2)有人认为上述反应说明了碘单质是过氧化氢分解的催化剂,你认为________(填“对”或“不对”),其理由是________.
(3)上述反应说明H2O2,I2,HIO氧化性从强到弱的顺序是________.
答案:
解析:
解析:
|
(1)B (2)对,从反应②,③可看出碘在反应前后质量没有变化 (3)HIO>H2O2>I2 导解:判断若干反应中某物质是否作催化剂,关键抓住催化剂特征:参与化学反应,改变化学反应的速率,而本身的质量和化学性质在反应前后均不变;判断物质氧化性强弱规律:氧化剂的氧化性大于氧化产物的氧化性. |

练习册系列答案
相关题目