题目内容
15.一定量的KIO3与SO2反应生成I2的反应为2KIO3+5SO2+4H2O=I2+4H2SO4+K2SO4,现有400mL含KIO3的溶液与0.48mol SO2反应生成I2为0.06mol,求生成的H+的浓度.分析 溶液与0.48mol SO2反应生成I2为0.06mol,由反应2KIO3+5SO2+4H2O=I2+4H2SO4+K2SO4可知参加该反应的二氧化硫为0.06mol×5=0.3mol,且SO2+I2+2H2O=H2SO4+2HI,以此来解答.
解答 解:由反应2KIO3+5SO2+4H2O=I2+4H2SO4+K2SO4可知参加该反应的二氧化硫为0.06mol×5=0.3mol,
则2KIO3+5SO2+4H2O=I2+4H2SO4+K2SO4,生成硫酸为0.06mol×2=0.12mol;
参加SO2+I2+2H2O=H2SO4+2HI反应的二氧化硫为(0.48mol-0.3mol)=0.18mol,则生成硫酸为0.18mol,HI为0.36mol,
所以生成的H+的浓度为$\frac{0.12mol×2+0.18mol×2+0.36mol}{0.4L}$=2.4mol/L
答:生成的H+的浓度为2.4mol/L.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意二氧化硫过量时不能存在碘单质,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
5.己烯雌酚[C18H20O2]的结构简式如图所示,下列有关叙述中不正确的是( )
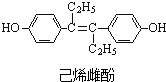

| A. | 与NaOH反应可生成化学式为C18H18O2Na2的化合物 | |
| B. | 聚己烯雌酚含有顺式和反式两种结构 | |
| C. | 1mol己烯雌酚最多可与7molH2发生加成反应 | |
| D. | 形成高分子 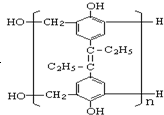 的单体中有己烯雌酚 的单体中有己烯雌酚 |
6.已知某种气态化石燃料只含有碳和氢两种元素.为了测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体(包括水)全部通入如图所示的装置,得到如表所示的实验数据(左侧U形管中干燥剂至吸收水蒸气且假设产生的气体完全被吸收,忽略澄清石灰水中的水分损失)
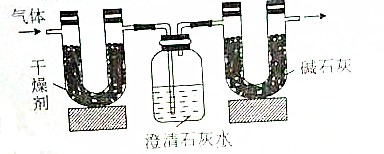
根据实验数据回答下列问题:
(1)实验完毕后,生成物中水的质量为1.35g,假设广口瓶里生成一种正盐,其质量为5g
(2)生成的水中氢元素的质量为0.15g.
(3)生成的CO2中碳元素的质量为0.6g.
(4)气态化石燃料的分子式为C2H6.

| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 51.10g | 52.45g |
| (澄清石灰水+广口瓶)的质量 | 408.00g | 410.20 |
(1)实验完毕后,生成物中水的质量为1.35g,假设广口瓶里生成一种正盐,其质量为5g
(2)生成的水中氢元素的质量为0.15g.
(3)生成的CO2中碳元素的质量为0.6g.
(4)气态化石燃料的分子式为C2H6.
10.向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/L FeCl3溶液,静置.观察并记录现象
| 步骤 | 向 MgCl2溶液中滴加NaOH溶液 | 向有白色沉淀的溶液中滴加FeCl3溶液 | 静置 |
| 现象 |
20.下列化合物的一氯代物的数目排列顺序正确的是( )
①CH3CH2CH2CH2CH2CH3②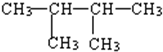 ③
③ ④
④
①CH3CH2CH2CH2CH2CH3②
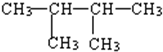 ③
③ ④
④
| A. | ①>②>③>④ | B. | ③=①>②>④ | C. | ③>②>④>① | D. | ②>③=①>④ |
7.下列说法正确的是( )
| A. | 气体的摩尔体积是22.4L | |
| B. | 1L 1mol/L MgCl2溶液中Cl-的物质的量浓度为1mol/L | |
| C. | 1mol NaOH的质量为40g | |
| D. | 1mol氧和1mol水所含的分子数相等 |
9.下列说法正确的是( )
| A. | 乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 | |
| B. | 二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理相同 | |
| C. | Ksp不仅与难溶电解质的性质和温度有关,而且还与溶液中的离子浓度有关 | |
| D. | 7.8g过氧化钠含有的共用电子对数为0.1NA |

 .
. .
. .
. 或
或  的邻、间、对的任意一种.
的邻、间、对的任意一种.