题目内容
【题目】燃料电池利用原电池的工作原理将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能:能有效提高能源利用率,具有广泛的应用前景。某种燃料电池的总反应式是:CH4+2O2+2OH-=CO32-+ 3H2O,装置如下图所示,该电池用金属铂片作电极在两极上分别通甲烷和氧气。请思考回答以下问题:
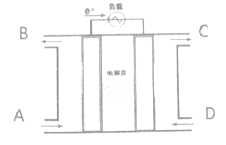
(1)电解质溶液可能是_________________;阳离子的移动方向:___________。(“左→右”、“右→左”)
(2)D气体通入的电池的_________极,发生的电极反应式:__________________;A通入的是______________,发生的电极反应式:_________________。
(3)当该电子流经导线的电子为4mol时,A入口至少需要通入_______L的气体(标准状态下)。
【答案】 NaOH或KOH 左![]() 右( 正极 O2+4e-+2H2O=4OH- CH4 CH4+8e-+10H-=CO32-+7H2O 11. 2L
右( 正极 O2+4e-+2H2O=4OH- CH4 CH4+8e-+10H-=CO32-+7H2O 11. 2L
【解析】(1)燃料电池的总反应式是:CH4+2O2+2OH-=CO32-+ 3H2O,可知电解质溶液是碱性溶液,可能是NaOH或KOH;由装置图可知,电子流出的极为负极,即左边电极为负极,则原电子工作时阳离子的移动方向左→右;
(2)右侧电极为正极,通话气体为氧气,则D气体通入的电池的正极,发生的电极反应式为O2+4e-+2H2O=4OH-;A通入的是CH4,发生的电极反应式CH4+8e-+10H-=CO32-+7H2O;
(3)当该电子流经导线的电子为4mol时,A入口甲烷的物质的量为4mol×![]() =0.5mol,标准状况下体积为0.5mol×22.4L/mol=11.2L。
=0.5mol,标准状况下体积为0.5mol×22.4L/mol=11.2L。

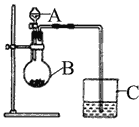
【题目】三氯氧磷(POCl2)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:
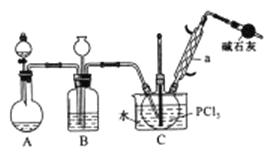
有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)装置A中发生反应的化学方程式为___________________________。
(2)B装置的作用除观察O2的流速之外。还有__________________________。
(3)C装置控制反应在60℃~65℃进行,其主要目的是_______________________。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取xg 产品于锥形瓶中,加入足量NaOH 溶液,待完全反应后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000mol/L 的AgNO3容液40.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用cmol/LNH4SCN 溶液滴定过量Ag+至终点,记下所用 体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是________________(填标号)。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②Cl元素的质量百分含量为(列出算式)____________________。
③步骤Ⅲ加入硝基苯的目的是_________________,如无此操作,所测Cl元素含量将会____________填“偏大”“ 偏小”或“不变”)。