题目内容
【题目】如图所示为密闭容器中反应C(s)+H2O(g)![]() CO(g)+H2(g) ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
CO(g)+H2(g) ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
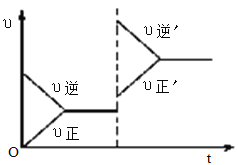
A. 起始反应物为CO和H2
B. 改变条件后平衡逆向移动
C. 新平衡时CO的浓度比原平衡小
D. 改变的条件是增大压强
【答案】C
【解析】A项,起始正反应速率为0,起始反应物为CO和H2;B项,改变条件后υ逆ˊ![]() υ正ˊ,平衡逆向移动;C项,由于改变条件后正、逆反应速率都加快且υ逆ˊ
υ正ˊ,平衡逆向移动;C项,由于改变条件后正、逆反应速率都加快且υ逆ˊ![]() υ正ˊ,所以改变的条件是增大压强,根据勒夏特列原理,新平衡时CO的浓度比原平衡大;D项,由于改变条件后正、逆反应速率都加快且υ逆ˊ
υ正ˊ,所以改变的条件是增大压强,根据勒夏特列原理,新平衡时CO的浓度比原平衡大;D项,由于改变条件后正、逆反应速率都加快且υ逆ˊ![]() υ正ˊ,所以改变的条件是增大压强。
υ正ˊ,所以改变的条件是增大压强。
A项,起始正反应速率为0,起始反应物为CO和H2,A项正确;B项,改变条件后υ逆ˊ![]() υ正ˊ,平衡逆向移动,B项正确;C项,由于改变条件后正、逆反应速率都加快,改变的条件不可能是增大浓度,该反应的正反应为气体分子数增大的吸热反应,改变条件后υ逆ˊ
υ正ˊ,平衡逆向移动,B项正确;C项,由于改变条件后正、逆反应速率都加快,改变的条件不可能是增大浓度,该反应的正反应为气体分子数增大的吸热反应,改变条件后υ逆ˊ![]() υ正ˊ,改变的条件不可能是升高温度或使用催化剂,则改变的条件是增大压强,增大压强平衡逆向移动,根据勒夏特列原理,新平衡时CO的浓度比原平衡大,C项错误;D项,由于改变条件后正、逆反应速率都加快且υ逆ˊ
υ正ˊ,改变的条件不可能是升高温度或使用催化剂,则改变的条件是增大压强,增大压强平衡逆向移动,根据勒夏特列原理,新平衡时CO的浓度比原平衡大,C项错误;D项,由于改变条件后正、逆反应速率都加快且υ逆ˊ![]() υ正ˊ,所以改变的条件是增大压强,D项正确;答案选C。
υ正ˊ,所以改变的条件是增大压强,D项正确;答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目