题目内容
【题目】不锈钢主要是由铁、镍、铜、碳等元素所组成的合金。具有优异的抗腐蚀性能。
(1)铁元素在周期表中的位置是________________,其基态原子的价电子排布图为___________________,基态三价阳离子最外层有________种运动状态不同的电子。
(2)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n ,Ni(CO)n晶体属于___(填晶体类型)。写出一个与Ni(CO)n中配体互为等电子体的离子的化学式为___________。
(3)已知铜晶体为面心立方最密堆积,若该晶体中一个晶胞的边长为a cm,则铜晶体的密度为________________g/cm3(写出含a的表达式,用NA表示阿伏加德罗常数的值)。若铜的原子半径为r cm ,则在铜晶胞中用r表示出这种堆积模型的空间利用率为_________(保留两位小数)。
(4)邻羟基苯甲酸(又名水杨酸,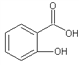 )和对羟基苯甲酸(
)和对羟基苯甲酸(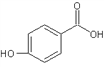 )都是二元酸。二者沸点相差较大的理由是_______________________________。已知苯酚(
)都是二元酸。二者沸点相差较大的理由是_______________________________。已知苯酚(![]() )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子![]() 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”)。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”)。
【答案】第四周期第Ⅷ族![]() 13分子晶体CN-(C22- 、O22+)256/a3NA0.74对羟基苯甲酸只在分子间形成氢键,邻羟基苯甲酸只在分子内形成氢键,所以前者沸点高于后者<
13分子晶体CN-(C22- 、O22+)256/a3NA0.74对羟基苯甲酸只在分子间形成氢键,邻羟基苯甲酸只在分子内形成氢键,所以前者沸点高于后者<
【解析】
试题(1)铁基态原子电子排布式为1s22s22p63s23p63d64s2,铁的外围电子排布是3d64s2;基态三价阳离子电子排布式为1s22s22p63s23p63d5,最外层有13个电子;(2)根据Ni(CO)n是易挥发液体分析;Ni(CO)n中配体是CO,等电子体是原子数相同、价电子数相同的微粒;(3)铜晶体为面心立方最密堆积,则1个晶胞含有铜原子数是![]() ;铜晶体为面心立方最密堆积,若铜的原子半径为r cm ,则晶胞边长为
;铜晶体为面心立方最密堆积,若铜的原子半径为r cm ,则晶胞边长为![]() cm 。(4)对羟基苯甲酸只在分子间形成氢键,邻羟基苯甲酸只在分子内形成氢键;
cm 。(4)对羟基苯甲酸只在分子间形成氢键,邻羟基苯甲酸只在分子内形成氢键;![]() 中形成分子内氢键,使该微粒中酚羟基更难电离出H+;
中形成分子内氢键,使该微粒中酚羟基更难电离出H+;
解析:(1)铁基态原子电子排布式为1s22s22p63s23p63d64s2,铁在周期表中的位置是第四周期第Ⅷ族,铁的价电子排布图为3d64s2;基态三价阳离子电子排布式为1s22s22p63s23p63d5,最外层有13个电子,所以最外层有13种运动状态不同的电子;(2)Ni(CO)n是易挥发液体,说明熔点低,属于分子晶体;Ni(CO)n中配体是CO,其等电子体是CN-或C22-;(3)铜晶体为面心立方最密堆积,则1个晶胞含有铜原子数是![]() ;一个晶胞的边长为a cm,晶胞的体积为
;一个晶胞的边长为a cm,晶胞的体积为![]() ,则铜晶体的密度为
,则铜晶体的密度为![]() g/cm3;若铜的原子半径为r cm ,则晶胞边长为
g/cm3;若铜的原子半径为r cm ,则晶胞边长为![]() cm,晶胞的体积是
cm,晶胞的体积是![]() ,1个晶胞含有4个铜原子, 4个铜原子的体积是
,1个晶胞含有4个铜原子, 4个铜原子的体积是![]() ,这种堆积模型的空间利用率为
,这种堆积模型的空间利用率为![]()
![]()
![]() =0.74;(4)对羟基苯甲酸只在分子间形成氢键,邻羟基苯甲酸只在分子内形成氢键,所以所以前者沸点高于后者;
=0.74;(4)对羟基苯甲酸只在分子间形成氢键,邻羟基苯甲酸只在分子内形成氢键,所以所以前者沸点高于后者;![]() 中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)。
中形成分子内氢键,使该微粒中酚羟基更难电离出H+,导致该微粒酸性小于苯酚,所以相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)。

 名校课堂系列答案
名校课堂系列答案