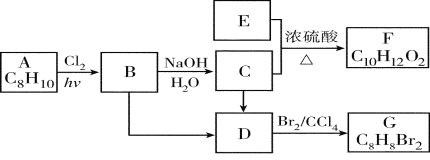
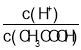题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.100g30%CH3COOH溶液中含氢原子数为2NA
B.标准状况下,11.2LCCl4中含有的C—Cl键的数目为2NA
C.16gO3和O2混合物中含氧原子数为NA
D.精炼铜过程中阳极质量减少6.4g时,电路中转移电子数等于0.2NA
【答案】C
【解析】
A.醋酸溶液中除了醋酸中含氢原子,水中也含氢原子,故溶液中的氢原子的个数为(![]() ×4+
×4+![]() ×2)×NA>2NA个,故A错误;
×2)×NA>2NA个,故A错误;
B.标准状况下,四氯化碳为液态,不能根据气体摩尔体积来计算其物质的量和C-Cl键的个数,故B错误;
C.氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量为n=![]() =1mol,含氧原子NA个,故C正确;
=1mol,含氧原子NA个,故C正确;
D.精炼铜时,阳极上为粗铜,而粗铜中除了铜,还含有比铜活泼的金属,故当阳极质量减少6.4g时,电路中转移的电子数不一定为0.2NA个,故D错误;
故选C。

练习册系列答案
相关题目