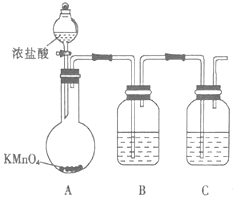
题目内容
15.工业上用乙苯为原料制苯乙烯.(1)Ⅰ.采用乙苯与CO2脱氢生产重要化工原料苯乙烯
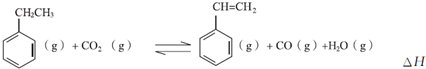
(1)①乙苯与CO2反应的平衡常数表达式为K=$\frac{c({C}_{6}{H}_{5}{CH=CH}_{2})?c(CO)?c({H}_{2}O)}{c({C}_{6}{H}_{5}{CH}_{2}{CH}_{3})?c({CO}_{2})}$.
②下列叙述不能说明乙苯与CO2反应已达到平衡状态的是bc.
a.v正(CO)=v逆(CO)
b.c(CO2)=c(CO)
c.消耗1 mol CO2同时生成1 mol H2O
d.CO2的体积分数保持不变
(2)在3 L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0 mol/L和3.0 mol/L,其中实验Ⅰ在T1℃,0.3 Mpa,而实验Ⅱ、Ⅲ分别改变了实验其他条件;乙苯的浓度随时间的变化如图Ⅰ所示.
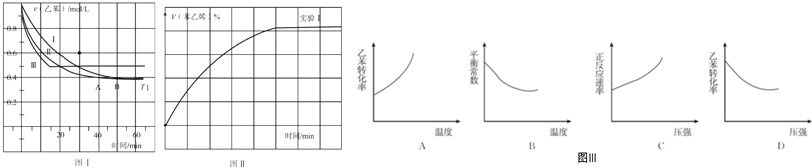
①实验Ⅰ乙苯在0~50 min内的反应速率为0.012mol/(L•min).
②实验Ⅱ可能改变条件的是加催化剂.
③图Ⅱ是实验Ⅰ中苯乙烯体积分数V%随时间t的变化曲线,请在图Ⅱ中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线.
(3)若实验Ⅰ中将乙苯的起始浓度改为1.2 mol/L,保持其他条件不变,乙苯的转化率将减小(填“增大”“减小”或“不变”),计算此时平衡常数为0.225.
(2)Ⅱ.利用乙苯的脱氢反应制苯乙烯.

达到平衡后改变反应条件,图(Ⅲ)中曲线变化不正确的是B.
分析 Ⅰ.(1)①乙苯与CO2反应的平衡常数表达式为K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
(2)①实验I乙苯在0-50min内浓度变化量为(1-0.4)mol/L=0.6mol/L,再根据v=$\frac{△c}{△t}$计算;
②实验Ⅱ与实验I相比,反应速率加快,但平衡不移动,应是加入催化剂;
③实验Ⅲ与实验I相比,反应速率加快,开始阶段相同时间内实验Ⅲ中苯乙烯的体积分数较大,但平衡时乙苯的浓度增大,平衡逆向移动,平衡时苯乙烯的体积分数小于实验I;
(3)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,等效压强增大到达平衡后在移走部分二氧化碳,增大压强平衡逆向移动,移走二氧化碳平衡逆向移动;
计算实验Ⅰ中平衡时时各组分的浓度,代入平衡常数K=$\frac{c({C}_{6}{H}_{5}CH=C{H}_{2})c(CO)c({H}_{2}O)}{c({C}_{6}{H}_{5}C{H}_{2}C{H}_{3})×c(C{O}_{2})}$计算;
Ⅱ.该反应正方向是气体体积增大的方向,正反应为吸热反应;根据温度、压强对平衡的影响分析;
解答 解:Ⅰ.(1)①乙苯与CO2反应的平衡常数表达式为K=$\frac{c({C}_{6}{H}_{5}CH=C{H}_{2})c(CO)c({H}_{2}O)}{c({C}_{6}{H}_{5}C{H}_{2}C{H}_{3})×c(C{O}_{2})}$,
故答案为:$\frac{c({C}_{6}{H}_{5}{CH=CH}_{2})?c(CO)?c({H}_{2}O)}{c({C}_{6}{H}_{5}{CH}_{2}{CH}_{3})?c({CO}_{2})}$;
②a.当反应达到平衡状态时,正逆反应速率相等(同种物质),v正(CO)=v逆(CO),反应达到平衡状态,故a正确;
b.c(CO2)与c(CO)的浓度是否相等,与反应的起始量和转化率有关,所以当c(CO2)=c(CO)时,不能说明已经达到平衡状态,故b错误;
c.消耗1molCO2为正速率,同时生成1molH2O也是正速率,都是正速率,二者始终相等,不能说明已经达到平衡状态,故c错误;
d.随着反应的进行CO2的体积分数逐渐减小,当CO2的体积分数保持不变,即是平衡状态,故d正确;故选bc.
故答案为:bc;
(2)①根据图I中可知,0-50min时乙苯的浓度变化为:1.0mol/L-0.4mol/L=0.6mol/L,则乙苯的反应速率v=$\frac{0.6mol/L}{50min}$=0.012mol/(L•min),
故答案为:0.012mol/(L•min);
②实验Ⅱ与实验I相比,反应速率加快,但平衡不移动,应是加入催化剂,故答案为:加催化剂;
③实验Ⅲ与实验I相比,反应速率加快,开始阶段相同时间内实验Ⅲ中苯乙烯的体积分数较大,但平衡时乙苯的浓度增大,平衡逆向移动,平衡时苯乙烯的体积分数小于实验I,则实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线为 ,
,
故答案为: ;
;
(3)若实验I中将乙苯的起始浓度改为1.2mol/L,其他条件不变,等效压强增大到达平衡后在移走部分二氧化碳,增大压强平衡逆向移动,移走二氧化碳平衡逆向移动,故所以乙苯的转化率减小;
根据图I中实验1可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L
C6H5CH2CH3+CO2?C6H5CH=CH2 +CO+H2O
起始浓度(mol/L):1.0 3.0 0 0 0
反应浓度(mol/L):0.6 0.6 0.6 0.6 0.6
平衡浓度(mol/L):0.4 2.4 0.6 0.6 0.6
则平衡常数K=$\frac{c({C}_{6}{H}_{5}CH=C{H}_{2})c(CO)c({H}_{2}O)}{c({C}_{6}{H}_{5}C{H}_{2}C{H}_{3})×c(C{O}_{2})}$=$\frac{0.6×0.6×0.6}{0.4×2.4}$=0.225,
故答案为:减小;0.225;
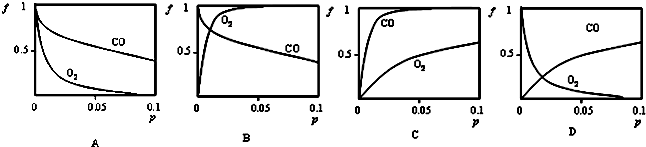
Ⅱ.A.该反应的正方向为吸热反应,升温平衡向着正方向移动,乙苯的转化率升高,故A正确;
B.该反应的正方向为吸热反应,升温平衡向着正向移动,平衡常数增大,故B错误;
C.增大压强,正反应速率增大,故C正确;
D.该反应是体积增大的反应,增大压强,平衡向着逆方向移动,苯乙烯的转化率减小,故D正确.
故答案为:B.
点评 本题考查化学平衡影响因素、反应速率计算、化学平衡常数的计算,题目难度中等,作图为易错点,学生容易考虑到达平衡时间及苯乙烯体积分数,易忽略开始阶段相同时间内实验Ⅲ中苯乙烯的体积分数较大.

 阅读快车系列答案
阅读快车系列答案| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0 |
(2)3.7g该样品进行同样实验时,生成的氨气在标准状况下体积为0.84L.
(3)试求算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比.
(4)欲计算该NaOH溶液的物质的量浓度应选择第Ⅲ组数据,并由此计算NaOH溶液的物质的量浓度,写出计算过程.
(1)恒容密闭窗口中,工业固氮反应N2(g)+3H2(g)?2NH3(g)的化学平衡常数K和温度的关系如表所示:
| 温度/℃ | 25 | 200 | 300 | 400 | 500 |
| K | 5×108 | 1.0 | 0.86 | 0.507 | 0.152 |
②有关工业合成氨的研究成果,曾于1918年、1931年、2007年三次荣膺诺贝尔化学奖.
下列关于合成氨反应描述的图象中,不正确的是C(填序号).
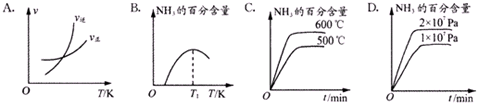
③400℃时,测得某时刻氨气、氮气、氢气物质的量浓度分别为3mol•L-1、2mol•L-1、1mol•L-1,则该反应的v正<v逆(填“>”、“<”或“=”)
(2)近年来,科学家又提出在常温、常压、催化剂等条件下合成氨的新思路,反应原理为:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),则其反应热△H=+1530kJ•mol-1.[已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)?2H2O(1)△H=-571.6kJ•mol-1]
(3)联氨(N2H4)、二氧化氮(NO2)可与KOH溶液构成碱性燃料电池,其电池反应原理为2N2H4+2NO2═3N2+4H2O,则负极的电极反应式为N2H4-4e-+4OH-=N2+4H2O.
(4)25℃时,将pH=3的盐酸和pH=11的氨水等体积混合后,溶液中的离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+).
(5)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液中c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+)(填表达式).(已知:H2SO3的Ka1=1.7×10-2mol•L-1,Ka2=6.0×10-8mol•L-1;NH3•H2O的Kb=1.8×10-5mol•L-1)
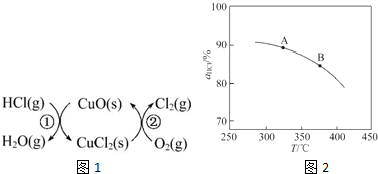
(1)传统上该转化通过如下所示的催化循环实现.其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1反应②生成1mol Cl2(g)的反应热为△H2,则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热用△H1和△H2表示).
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性.
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的转化率αHCl~T曲线如图1:则总反应的△H<0(填“>”“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,画出相应αHCl~T曲线的示意图1
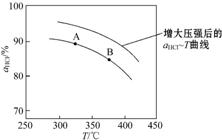 ,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.③下列措施中,有利于提高αHCl的有BD.
A.增大n(HCl) B.增大n(O2) C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
①CO ②H2 ③CH4 ④HCHO ⑤CH3COOH ⑥HCOOH.
| A. | ①②⑥ | B. | ③④⑤ | C. | ①②④⑤ | D. | ②③⑤ |
| A. | “钴酞菁”的分子(直径为1.3×10-9m)在水中形成的分散系能产生丁达尔效应 | |
| B. | 氢氟酸可用细口玻璃试剂瓶保存 | |
| C. | 粘附有硫单质的试管可用酒精洗涤 | |
| D. | “地沟油”分馏可制得矿物柴油 |
| A. | 金属钠投入CuSO4溶液中:2Na+Cu2+═2Na++Cu | |
| B. | 过量的CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O═HCO3-+HClO | |
| C. | 向Mg(OH)2悬浊液中滴加四滴0.1mol•L-1FeCl3溶液:3Mg(OH)2(S)+2Fe3+(aq)═2Fe(OH)3(S)+3Mg2+(aq) | |
| D. | 铅酸蓄电池充电时的阳极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |