题目内容
(1)在一定条件下可以进行如下反应:H2O+R2O8n-+Mn2+→MnO4-+RO42-+H+(未配平),又知该反应中氧化剂与还原剂的物质的量之比为5:2,则R2O8n-中n的值为______.
(2)反应 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 可用于实验室制取氯气
①用双线桥表示出该反应的电子转移情况:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
②在标准状况下,该反应产生2.24L Cl2时,消耗氧化剂______mol,被氧化的物质的质量为______g.
解:(1)反应中R2O8n-是氧化剂,Mn2+是还原剂,令R2O8n-中R元素的化合价为a,根据电子转移守恒有5×2×(a-6)=2×(7-2),解得a=+7,离子电荷等于各元素化合价的代数和,所以2×7+(-2)×8=-n,解得n=2,故答案为:2;
(2)反应中KMnO4中Mn元素获得10电子生成MnCl2,HCl中Cl元素失去10个电子生成Cl2.用双线桥表示出该反应的电子转移情况为: ,
,
故答案为: ;
;
(3)标准状况下,2.24L Cl2物质的量为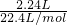 =0.1mol,反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,KMnO4中Mn元素化合价降低,KMnO4是氧化剂,
=0.1mol,反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,KMnO4中Mn元素化合价降低,KMnO4是氧化剂,
根据方程式可知消耗的KMnO4的物质的量0.1mol× =0.04mol;
=0.04mol;
反应中HCl原子Cl元素化合价降低,HCl是还原剂被氧化生成Cl2,根据氯元素守恒可知n(HCl)=2n(Cl2)=0.1mol×2=0.2mol,被氧化的HCl的质量为0.2mol×36.5g/mol=7.3g.
故答案为:0.04;7.3.
分析:(1)令R2O8n-中R元素的化合价为a,根据电子转移守恒计算a的值,再根据离子电荷等于各元素化合价的代数和计算n;
(2)反应中KMnO4中Mn元素获得10电子生成MnCl2,HCl中Cl元素失去10个电子生成Cl2.双线桥表示方法为化合价变化的同一元素用直线加箭头从反应物指向生成物,并在上方注明“得”或“失”及转移电子数目;
(3)反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,KMnO4中Mn元素化合价降低,KMnO4是氧化剂,根据方程式计算消耗的KMnO4的物质的量;反应中HCl原子Cl元素化合价降低,HCl是还原剂被氧化生成Cl2,根据氯元素守恒可知n(HCl)=2n(Cl2),再根据m=nM计算被氧化的HCl的质量.
点评:本题考查氧化还原反应的有关计算等,难度中等,注意氧化还原反应中电子转移守恒计算运用.
(2)反应中KMnO4中Mn元素获得10电子生成MnCl2,HCl中Cl元素失去10个电子生成Cl2.用双线桥表示出该反应的电子转移情况为:
 ,
,故答案为:
 ;
;(3)标准状况下,2.24L Cl2物质的量为
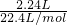 =0.1mol,反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,KMnO4中Mn元素化合价降低,KMnO4是氧化剂,
=0.1mol,反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,KMnO4中Mn元素化合价降低,KMnO4是氧化剂,根据方程式可知消耗的KMnO4的物质的量0.1mol×
 =0.04mol;
=0.04mol;反应中HCl原子Cl元素化合价降低,HCl是还原剂被氧化生成Cl2,根据氯元素守恒可知n(HCl)=2n(Cl2)=0.1mol×2=0.2mol,被氧化的HCl的质量为0.2mol×36.5g/mol=7.3g.
故答案为:0.04;7.3.
分析:(1)令R2O8n-中R元素的化合价为a,根据电子转移守恒计算a的值,再根据离子电荷等于各元素化合价的代数和计算n;
(2)反应中KMnO4中Mn元素获得10电子生成MnCl2,HCl中Cl元素失去10个电子生成Cl2.双线桥表示方法为化合价变化的同一元素用直线加箭头从反应物指向生成物,并在上方注明“得”或“失”及转移电子数目;
(3)反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,KMnO4中Mn元素化合价降低,KMnO4是氧化剂,根据方程式计算消耗的KMnO4的物质的量;反应中HCl原子Cl元素化合价降低,HCl是还原剂被氧化生成Cl2,根据氯元素守恒可知n(HCl)=2n(Cl2),再根据m=nM计算被氧化的HCl的质量.
点评:本题考查氧化还原反应的有关计算等,难度中等,注意氧化还原反应中电子转移守恒计算运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

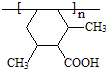






 )分子获得2个氢原子后,转变成1个芳香族化合物分子,该芳香族化合物分子的结构简式为
)分子获得2个氢原子后,转变成1个芳香族化合物分子,该芳香族化合物分子的结构简式为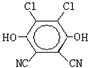
 与1分子
与1分子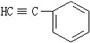 在一定条件下可发生类似①的反应,其产物分子的结构简式为
在一定条件下可发生类似①的反应,其产物分子的结构简式为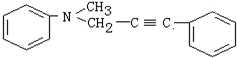



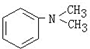
 与 1 分子
与 1 分子 在一定条件下可发生类似反应①的反应,其产物分子的结构简式为________;1 mol 该产物最多可与________mol H2发生加成反应。
在一定条件下可发生类似反应①的反应,其产物分子的结构简式为________;1 mol 该产物最多可与________mol H2发生加成反应。


 与1分子
与1分子 在一定条件下可发生类似反应①的反应,其产物分子的结构简式为____________;1mol该产物最多可与______molH2发生加成反应。
在一定条件下可发生类似反应①的反应,其产物分子的结构简式为____________;1mol该产物最多可与______molH2发生加成反应。

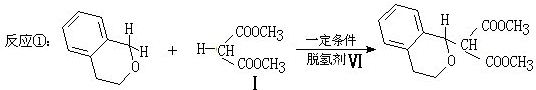
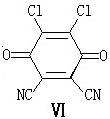
 与1分子
与1分子 在一定条件下可发生类似反应①的反应,生成有机化合物VI,VI的结构简式为
。
在一定条件下可发生类似反应①的反应,生成有机化合物VI,VI的结构简式为
。