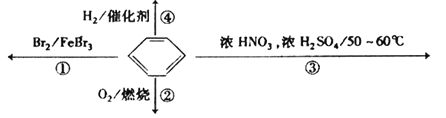
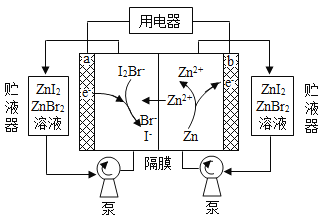
题目内容
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液; ⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是______(填编号)。若测定结果偏高,其原因可能是________(填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质 B.滴定终点读数时,仰视滴定管的刻度,其他操作正确 C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 D.所配的标准NaOH溶液物质的量浓度偏大
(2)判断滴定终点的现象是_____________________________________。
(3)如图是某次滴定时的滴定管中的液面,其读数为________mL。

(4)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
(5)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已在H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
①用太阳能分解10 mol水消耗的能量是________kJ。
②CH3OH(l)不完全燃烧生成一氧化碳和液态水的热化学方程式为________________。
【答案】① ABC 滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红色,且半分钟内不恢复原色 22.60 0.2000 2858 CH3OH(l)+O2(g)―→CO(g)+2H2O(l)ΔH=-443.5 kJ·mol-1
【解析】
(1)溶液装入滴定管前应先进行润洗;根据c(待测)=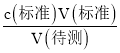 分析浓度的误差;
分析浓度的误差;
(2)滴定终点时溶液颜色由无色变为红色,且半分钟内不褪色;
(3)根据图片读取液体体积;
(4)根据表格中数据,利用公式c(待测)=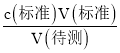 计算盐酸的浓度;
计算盐酸的浓度;
(5)根据H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1可书写出燃烧热的热化学方程式:
① ![]()
②![]()
③![]() ,根据盖斯定律书写正确的热化学方程式。
,根据盖斯定律书写正确的热化学方程式。
(1)①用蒸馏水洗涤碱式滴定管,用标准NaOH溶液润洗碱式滴定管2-3次后,注入NaOH溶液至“0”刻度线以上;
A. 配制标准溶液的固体NaOH中混有KOH杂质,标准溶液中OH-的浓度偏小,消耗的V(标准)增大,因此,测定结果偏高,A项正确;
B. 滴定终点读数时,仰视滴定管的刻度,读取的V(标准)偏大,因此,测定结果偏高,B项正确;
C. 盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗,消耗的V(标准)偏大,因此,测定结果偏高,C项正确;
D. 所配的标准NaOH溶液物质的量浓度偏大,滴定过程中溶液变红色较早,消耗的V(标准)偏小,测定结果偏低,D项错误;
答案选ABC;
(2)滴定终点时溶液颜色由无色变为红色,且半分钟内不褪色;
(3)由图可知液体的体积为22.60ml;
(4)由表格中数据可知,三次实验分别消耗烧碱溶液20.00ml、22.10ml、20.00ml,第二次实验误差较大,数据舍弃,第一次和第三次两次平均消耗少碱溶液![]() =20.00ml,因此盐酸的浓度c(待测)=
=20.00ml,因此盐酸的浓度c(待测)=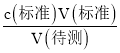 =
=![]() =0.2000mol/L;
=0.2000mol/L;
(5)①根据反应① ![]() 可知,分解1mol水,消耗285.8 kJ能量,若分解10mol水,消耗2858 kJ能量;
可知,分解1mol水,消耗285.8 kJ能量,若分解10mol水,消耗2858 kJ能量;
②根据盖斯定律可知反应③-②可得CH3OH(l)不完全燃烧生成一氧化碳和液态水的热化学方程式,即CH3OH(l)+O2(g)―→CO(g)+2H2O(l) ΔH=-443.5 kJ·mol-1。

 阅读快车系列答案
阅读快车系列答案【题目】某温度下,反应2A(g)![]() B(g)+C(g)的平衡常数为1,在容积为2 L的密闭容器中加入A(g)。20 s时测得各组分的物质的量如下表:
B(g)+C(g)的平衡常数为1,在容积为2 L的密闭容器中加入A(g)。20 s时测得各组分的物质的量如下表:
物 质 | A(g) | B(g) | C(g) |
物质的量/mol | 1.2 | 0.6 | 0.6 |
下列说法正确的是( )
A. 反应前20 s的平均速率为v(A)=0.6 mol·L-1·s-1
B. 20 s时,正反应速率等于逆反应速率
C. 达平衡时,A(g)的转化率为100%
D. 若升高温度,平衡常数变为0.6,则反应的ΔH<0