题目内容
【题目】如图,C、D、E、F、X、Y都是惰性电极,A、B为电源。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.

(1)若用CO、氧气燃料电池作电源,电解质为KOH溶液,则A为____极,A电极上的反应为__________________,B电极上的反应式为:__________________________________。
(2)若甲中装有100ml 1 molL-1的硫酸铜溶液,工作一段时间后,停止通电此时C、D两极上产生的气体体积相同.甲中D极产生的气体在标准状况下的体积为_____________L,欲使溶液恢复到起始状态,可向溶液中加入____。
A.CuO B.Cu2(OH)2CO3 C.Cu(OH)2 D.CuCO3
(3)通电后乙中反应的化学方程式:__________________________________。
(4)欲用(丙)装置给铜镀银,反应一段时间后(用CO、氧气燃料电池作电源)铜制品质量增加43.2克,理论上消耗氧气的质量_______克。
(5)工作一段时间后,丁中X极附件的颜色逐渐变浅,Y极附件的颜色逐渐变深,这说明__________________在电场作用下向Y极移动。
【答案】正 O2+4e-+2H2O=4OH- CO-2e-+4OH-=CO32-+2H2O 2.24 C 2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑ 3.2 氢氧化铁胶体粒子带正电荷
2NaOH+H2↑+Cl2↑ 3.2 氢氧化铁胶体粒子带正电荷
【解析】
本题考查的是电解池的工作原理,根据实验现象判断电解池的阴阳极和电极反应是关键。
(1)电解食盐水时F极附近显红色,说明F为阴极,则对应的B为负极,A为正极。若用CO、氧气燃料电池作电源,则氧气在正极反应生成氢氧根离子,电极反应为:O2+4e-+2H2O=4OH- ;一氧化碳在负极反应,电极反应为: CO-2e-+4OH-=CO32-+2H2O。(2) 若甲中装有100ml1 molL-1的硫酸铜溶液,说明首先电解硫酸铜生成铜和氧气和硫酸,然后电解水生成氢气和氧气,0.1mol硫酸铜完全电解生成0.05mol氧气,则假设电解水有xmol氧气生成,则同时生成2xmol氢气,有2x=x+0.05,解x=0.05mol,则D上产生0.1mol氢气,标况下体积为2.24L。 要想溶液恢复原来的成分和浓度需要加入0.1mol氧化铜和0.1mol水,或对应的物质,故选C。(3)通电后乙中为电解食盐水,生成氯气和氢气和氢氧化钠,方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。(4)欲用(丙)装置给铜镀银,反应一段时间后(用CO、氧气燃料电池作电源)铜制品质量增加43.2克,则说明析出43.2克银,即43.2/108=0.04mol银,则理论上消耗氧气0.01mol质量为3.2g。 (5)一段时间后X极附件的颜色逐渐变浅,Y极附件的颜色逐渐变深,说明氢氧化铁胶体粒子向阴极移动,则说明氢氧化铁胶体粒子带正电荷。
2NaOH+H2↑+Cl2↑。(4)欲用(丙)装置给铜镀银,反应一段时间后(用CO、氧气燃料电池作电源)铜制品质量增加43.2克,则说明析出43.2克银,即43.2/108=0.04mol银,则理论上消耗氧气0.01mol质量为3.2g。 (5)一段时间后X极附件的颜色逐渐变浅,Y极附件的颜色逐渐变深,说明氢氧化铁胶体粒子向阴极移动,则说明氢氧化铁胶体粒子带正电荷。

 科学实验活动册系列答案
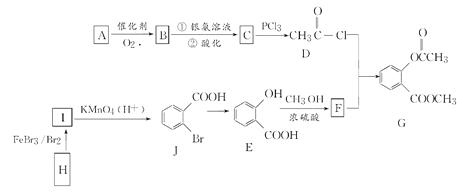
科学实验活动册系列答案【题目】铬是重要的战略物质之一,由于具有质硬,耐磨,耐高温,抗腐蚀性等特性,所以在工业上应用比较广泛,在冶金工业上主要用铬铁矿(Cr2O3 、FeO、SiO2 、Al2O3 等,其它杂质不参加反应)生产铬和铁等金属。流程如下:
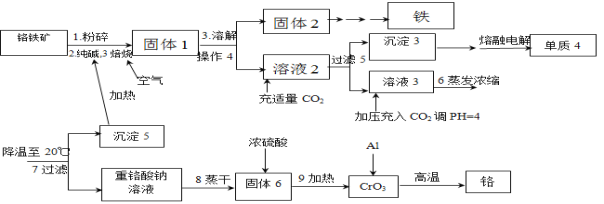
已知:2Cr2O3+3O2+4Na2CO3![]() 4Na2CrO4+4CO2;部分物质的溶解度(单位g)
4Na2CrO4+4CO2;部分物质的溶解度(单位g)
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | |
Na2CO3 | 7.0 | 13 | 29 | 40 | 49 | 46 | 44 |
NaHCO3 | 6.9 | 8.5 | 9.6 | 11.1 | 12.7 | 14.4 | 16.9 |
Na2Cr2O7 | 161 | 170 | 183 | 198 | 218 | 240 | 265 |
(1)粉碎的目的
(2)写出焙烧时含铝物质发生的化学反应方程式_______________________________;
(3)操作4是_______________________,沉淀3含有的物质有_____________________;
(4)写出生成沉淀5的离子方程式_____________________________________________;
(5)整个流程可以循环使用的物质有___________________________;
(6)最后一步制备金属铬的化学方程式______________________________。
【题目】如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是
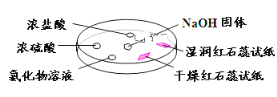
选项 | 实验现象 | 解释 |
A | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是MgCl2溶液 |
D | 浓盐酸附近产生白烟 | NH3与浓盐酸挥发出的HCl反应产生了NH4Cl固体 |
A. A B. B C. C D. D